
| A. | 电解质不一定能导电 | |
| B. | 氨溶于水得到的氨水能导电,所以氨水是电解质 | |
| C. | 将硫酸钡放入水中不能导电,所以硫酸钡是非电解质 | |
| D. | 在水溶液或熔融状态下能导电的物质叫做电解质 |
分析 A.电解质所处状态下不一定存在自由移动的离子,则不一定导电;
B.氨水本身不能电离,属于非电解质;
C.硫酸钡在熔融状态下完全电离,为强电解质;
D.电解质必须为化合物.
解答 解:A.存在自由移动的离子时能够导电,则电解质不一定能够导电,如固体氯化钠、硫酸钾等属于电解质,但不导电,故A正确;
B.氨水中一水合氨为电解质,而氨气自身不电离,为非电解质,故B错误;
C.硫酸钡为难溶物,其水溶液不导电,但是硫酸钡在熔融状态下能够导电,属于电解质,故C错误;
D.在水溶液或熔融状态下能导电的化合物叫做电解质,必须指出化合物,故D错误;
故选A.
点评 本题考查了电解质与非电解质的概念与判断,题目难度不大,明确电解质与非电解质的概念为解答关键,注意掌握电解质与溶液导电性的关系,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 通过煤的气化和液化获得洁净的燃料 | |
| B. | 加快核能、太阳能、沼气等新能源的开发利用 | |
| C. | 减少资源消耗,注重资源的重复使用、资源的循环再生 | |
| D. | 大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烷是直链烃,所以分子中3个碳原子也在一条直线上 | |
| B. | 丙烯所有原子均在同一平面上 | |
| C. | 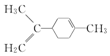 所有碳原子一定在同一平面上 所有碳原子一定在同一平面上 | |
| D. |  至少有16个原子共平面,至少8原子共线 至少有16个原子共平面,至少8原子共线 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氯化硫酰(SO2Cl2)主要用作氯化剂.它是一种无色液体,熔点-54.1℃,沸点69.1℃.氯化硫酰可用干燥的二氧化硫和氯气在活性炭催化剂存在下反应制取:
氯化硫酰(SO2Cl2)主要用作氯化剂.它是一种无色液体,熔点-54.1℃,沸点69.1℃.氯化硫酰可用干燥的二氧化硫和氯气在活性炭催化剂存在下反应制取:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Z>M>N>X>Y | B. | M与N形成的化合物中N显正价 | ||
| C. | 单质沸点:Z>M>N>Y>X | D. | 最高正价:N>M=Y>Z=X |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤⑦⑧ | B. | ①④⑦⑧ | C. | ①⑥ | D. | ①④⑤⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
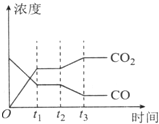 节能减排是当下环境保护的重点.
节能减排是当下环境保护的重点.| H2O | CO | C02 | H2 | |
| n/mol | 0.20 | 0.20 | 0 | 0 |
| 容器编号 | c(CO)/mol•L-1 | c(02)/mol•L-1 | c(C02)/mol•L-1 | V(正)和v(逆)比较 |
| Ⅰ | 2.0×10-4 | 4.0×10-4 | 4.0×10-2 | V(正)=v(逆 |
| Ⅱ | 3.0×10-4 | 4.0×10-4 | 5.0×10-2 | V(正)> v(逆 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com