
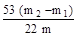 ×100%.
×100%.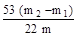 ×100%.。
×100%.。

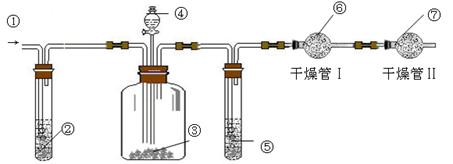
科目:高中化学 来源:不详 题型:实验题
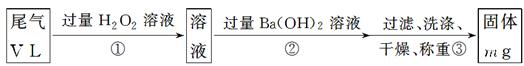
查看答案和解析>>
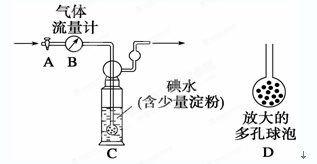
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
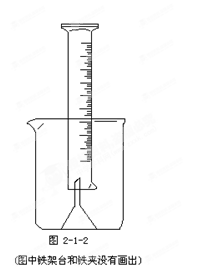
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

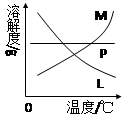
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
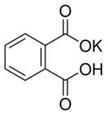
| 实验编号 | 邻苯二甲酸氢钾的质量(g) | 待测NaOH溶液的体积(mL) |
| 1 | 0.4080 | 18.20 |
| 2 | 17.10 | |
| 3 | 16.90 | |
| 4 | 17.00 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.某无色无味气体通入澄清石灰水中,石灰水变浑浊,则该气体为CO2 |
| B.某气体能使湿润的红色石蕊试纸变蓝,则该气体水溶液显碱性 |
| C.某无色溶液中加入盐酸酸化的BaCl2溶液,产生白色沉淀,则该溶液中一定有SO42- |
| D.用可见光束照射某红褐色液体产生丁达尔现象,则该液体为胶体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
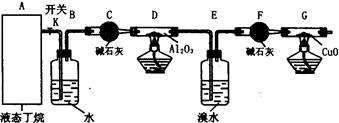
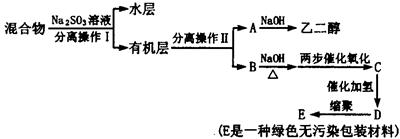
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
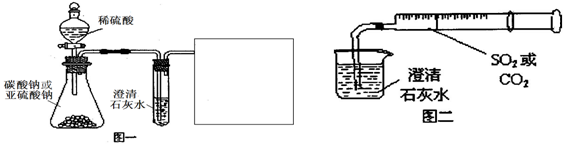
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com