
【题目】工业上可用合成气(主要成分为CO2、H2、CO)在催化剂作用下合成甲醇,并可用甲醇合成甲醚。
(1)CO2的电子式是________。
(2)已知:CO(g)+2H2(g)![]() CH3OH(g) △H1 = -90.77 kJ/mol
CH3OH(g) △H1 = -90.77 kJ/mol
CO2 (g)+H2 (g)![]() CO(g)+H2O(g) △H2 = +41.19 kJ/mol
CO(g)+H2O(g) △H2 = +41.19 kJ/mol
则CO2与H2反应制备CH3OH(g)的热化学方程式是________。
(3)向三个体积均为1L的恒容密闭容器中分别充入1mol CO2和3mol H2,在不同催化剂作用下同时反应制备CH3OH(g)。测得H2转化率随温度变化的数据如下表所示。

(注:T5时,H2转化率为66.67%,即转化了2/3)
①催化剂效果最佳的反应是________(填“I”“II”或“III”)。
②T3时,反应I的v(正)________v(逆)(填“>”“<”或“=”)。
③温度为T5时,该反应的平衡常数K=________。
(4)甲醇合成甲醚的反应为2CH3OH(g)![]() CH3OCH3(g)+H2O(g),反应过程中存在副反应2CH3OH(g)
CH3OCH3(g)+H2O(g),反应过程中存在副反应2CH3OH(g)![]() C2H4(g)+2H2O(g)。反应过程中的能量变化如图所示:
C2H4(g)+2H2O(g)。反应过程中的能量变化如图所示:

①反应速率较快的是________(填“Ⅰ”或“Ⅱ”),原因是________。
②根据反应原理,分析增大压强对合成甲醚的影响________。
【答案】 ![]() CO2(g)+3H2(g)
CO2(g)+3H2(g) ![]() CH3OH(g) +H2O (g) △H =-49.58kJ/mol Ⅰ > K=
CH3OH(g) +H2O (g) △H =-49.58kJ/mol Ⅰ > K=![]() Ⅰ 反应Ⅰ的活化能小于反应Ⅱ的活化能 增大压强加快反应速率, 抑制副反应的发生提高了甲醚的产率。
Ⅰ 反应Ⅰ的活化能小于反应Ⅱ的活化能 增大压强加快反应速率, 抑制副反应的发生提高了甲醚的产率。
【解析】(1)CO2的电子式是![]() ;(2)已知:①CO(g)+2H2(g)
;(2)已知:①CO(g)+2H2(g)![]() CH3OH(g) △H1 = -90.77 kJ/mol;②CO2 (g)+H2 (g)
CH3OH(g) △H1 = -90.77 kJ/mol;②CO2 (g)+H2 (g)![]() CO(g)+H2O(g) △H2 = +41.19 kJ/mol;根据盖斯定律,由①+②得反应CO2(g)+3H2(g)
CO(g)+H2O(g) △H2 = +41.19 kJ/mol;根据盖斯定律,由①+②得反应CO2(g)+3H2(g) ![]() CH3OH(g) +H2O (g) △H =-90.77 kJ/mol-41.19 kJ/mol =-49.58kJ/mol;(3)①根据CO2转化率随温度变化,推出反应I在T3时,转化率比反应Ⅱ、Ⅲ高,且最先达到平衡,因此催化效率最高的是反应I;②T3时,反应I的v(正) >v(逆);③达到平衡时,消耗CO2的物质的量浓度为:
CH3OH(g) +H2O (g) △H =-90.77 kJ/mol-41.19 kJ/mol =-49.58kJ/mol;(3)①根据CO2转化率随温度变化,推出反应I在T3时,转化率比反应Ⅱ、Ⅲ高,且最先达到平衡,因此催化效率最高的是反应I;②T3时,反应I的v(正) >v(逆);③达到平衡时,消耗CO2的物质的量浓度为: 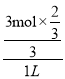 mol/L=
mol/L=![]() mol/L,
mol/L,
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
起始浓度: 1 3 0 0
变化浓度: ![]() 2
2 ![]()
![]()
平衡浓度: ![]() 1
1 ![]()
![]()
平衡常数K=![]() =
=![]() ;(4)①反应速率较快的是Ⅰ,原因是反应Ⅰ的活化能小于反应Ⅱ的活化能;②根据反应原理,分析增大压强对合成甲醚的影响增大压强加快反应速率, 抑制副反应的发生提高了甲醚的产率。
;(4)①反应速率较快的是Ⅰ,原因是反应Ⅰ的活化能小于反应Ⅱ的活化能;②根据反应原理,分析增大压强对合成甲醚的影响增大压强加快反应速率, 抑制副反应的发生提高了甲醚的产率。


科目:高中化学 来源: 题型:
【题目】如图是关于反应A2(g)+3B2(g)2C(g)(正反应为放热反应)的平衡移动图象,影响平衡移动的原因可能是( ) 
A.升高温度,同时加压
B.降低温度,同时减压
C.增大反应物浓度,同时减小生成物浓度
D.增大反应物浓度,同时使用催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2H4是一种高效清洁的火箭燃料.0.25mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ热量.则下列热化学方程中正确的是( )
A.![]() N2H4(g)+
N2H4(g)+ ![]() O2(g)=
O2(g)= ![]() N2(g)+H2O(l)△H=+267kJmol﹣1
N2(g)+H2O(l)△H=+267kJmol﹣1
B.N2H4(g)+O2(g)=N2(g)+2H2O(l)△H=﹣133.5kJmol﹣1
C.N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=+534kJmol﹣1
D.N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=﹣534kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25°C时,如图烧杯中各盛有50mL的溶液. 
(1)甲溶液PH=;
(2)若将甲溶液全部倒入乙中,所得的混合溶液的PH丙溶液的PH(填“>”、“<”或“=”).
(3)若将乙溶液全部倒入丙中,所得的混合溶液PH>7,所得溶液中离子浓度大小顺序是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三组溶液:①汽油和氯化钠溶液 ②39%的乙醇溶液 ③氯化钠和单质碘的水溶液,分离以上各混合液的正确方法依次是( )
A.分液、蒸馏、萃取B.萃取、蒸馏、分液
C.分液、萃取、蒸馏D.蒸馏、萃取、分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Sn 元素位于元素周期表第IVA 族,SnCl4可用作媒染剂和催化剂,工业上常用氯气与金属锡在300℃反应制备SnCl4。SnCl4 极易水解,SnCl2、SnCl4的一些物理数据如下:
物质 | 状态 | 熔点/℃ | 沸点/℃ |
Sn | 银白色固体 | 232 | 2260 |
SnCl2 | 无色晶体 | 246 | 652 |
SnCl4 | 无色液体 | -33 | 114 |
用下列装置合成四氯化锡(夹持装置略)。注:在仪器3 中各加入0.6 mL浓硫酸,实验操作如下:
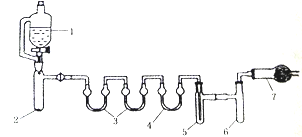
I.把干燥的仪器按图示装置连接好,在仪器1中加入B mL浓盐酸,在仪器2中加入2.0g KMnO4,在仪器5中加入2~3颗Sn粒;
II.打开活塞,让盐酸流下,均匀产生Cl2并充满整套装置,然后加热Sn粒,将生成的SnCl4收集在仪器6中;
III.Sn粒反应完毕后,停止加热,同时停止滴加盐酸,取下仪器6,迅速盖好盖子。
请回答:
(1)写出仪券2中发生化学反应方程式________________________。
(2)下列说法不正确的是______。
A.装置连接好,加入药品前要检查装置的气密性
B.产生的Cl2先充满整套装置,这步操作不可以省略
C.操作中应控制盐酸的滴入速率,不能太快,也不能太慢
D.仪器6 可用冰水浴冷却,也可以自然冷却
(3)仪器7 放的试剂是_______________________,作用是___________________、__________________。
(4)SnCl4在空气中与水蒸气反应除生成白色SnO2·xH2O固体,还可以看到___________________现象,化学方程式为___________________________________。
(5)经测定产品中含有少量的SnCl2,可能的原因___________( 用化学方程式表示)。
(6)产品中含少量SnCl2,测定SnCl4纯度的方法:取0.400 g产品溶于50 mL的稀盐酸中,加入淀粉溶液作指示剂,用0.0100mol/L碘酸钾标准溶液滴定至终点,消耗标准液8.00 mL,反应原理为:3SnCl2+ KIO3+ 6HCl==3SnCl4+ KI+ 3H2O,判断滴定终点的依据为______________________________,产品的纯 度为___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的两种方法:
方法a | 用炭粉在高温条件下还原CuO |
方法b | 电解法,反应为2Cu+H2O |
(1)工业上常用方法b制取Cu2O而很少用方法a,其原因是反应条件不易控制,若控温不当易生成__而使Cu2O产率降低。
(2)已知:
①2Cu(s)+ ![]() O2(g)
O2(g)![]() Cu2O(s) ΔH1=-169 kJ·mol-1
Cu2O(s) ΔH1=-169 kJ·mol-1
②C(s)+ ![]() O2(g)
O2(g)![]() CO(g) ΔH2=-110.5 kJ·mol-1
CO(g) ΔH2=-110.5 kJ·mol-1
③Cu(s)+![]() O2(g)
O2(g)![]() CuO(s) ΔH3=-157 kJ·mol-1
CuO(s) ΔH3=-157 kJ·mol-1
则方法a中发生的反应:2CuO(s)+C(s)= Cu2O(s)+CO(g);△H=________。
(3)方法b是用肼燃料电池为电源,通过离子交换膜电解法控制电解液中OH-的浓度来制备纳米Cu2O,装置如图所示:
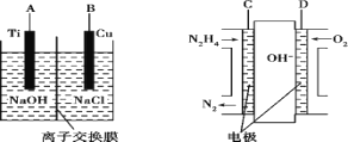
①上述装置中B电极应连_________电极(填“C”或“D”)。
②该离子交换膜为____离子交换膜(填“阴”或“阳”),该电解池的阳极反应式为_______。
③原电池中负极反应式为______________。
(4)在相同体积的恒容密闭容器中,用以上方法制得的两种Cu2O分别进行催化分解水的实验:2H2O(g) ![]() 2H2(g)+O2(g) ΔH>0。水蒸气的浓度随时间t的变化如下表所示:
2H2(g)+O2(g) ΔH>0。水蒸气的浓度随时间t的变化如下表所示:
序号 | 温度/℃c/mol·L-1t/min | 0 | 10 | 20 | 30 | 40 | 50 |
① | T1 | 0.050 | 0.049 2 | 0.048 6 | 0.048 2 | 0.048 0 | 0.048 0 |
② | T1 | 0.050 | 0.048 8 | 0.048 4 | 0.048 0 | 0.048 0 | 0.048 0 |
③ | T2 | 0.10 | 0.096 | 0.093 | 0.090 | 0.090 | 0.090 |
①催化剂的催化效率:实验①_______实验②(填“>”或“<”)。
②实验①、②、③的化学平衡常数K1、K2、K3的大小关系为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com