(2011?石景山区一模)短周期主族元素A、B、C、D、E,原子序数依次增大,A元素的单质常温常压下是最轻的气体,B元素所形成化合物种类最多,C的最高价氧化物对应水化物甲与其气态氢化物乙能够化合形成盐丙;D元素的离子半径是同周期元素形成的简单离子中最小的.
(1)已知相关物质之间存在如下变化:
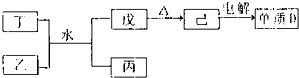
①丁与乙和水反应生成戊和丙的离子方程式为
Al3++3NH3?H2O=Al(OH)3↓+3NH4+
Al3++3NH3?H2O=Al(OH)3↓+3NH4+
,由物质己电解得到单质D的化学方程式为
;
②0.1mol/L的丙溶液中所含离子浓度由大到小排列顺序为
C(NO3-)>C(NH4+)>C(H+)>C(OH-)
C(NO3-)>C(NH4+)>C(H+)>C(OH-)
;常温下,为使丙溶液中由丙电离的阴、阳离子浓度相等,应向溶液中加入一定量的乙的水溶液至
溶液PH=7
溶液PH=7
.
(2)已知E及其化合物有以下变化:
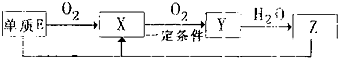
写出单质E与化合物Z在一定条件下反应生成X和水的化学方程式
_,由A、B、C、D、E5种元素中的两种元素,可形成既含极性键又含非极性键的18电子的分子,该分子的分子式为
C2H6或N2H4
C2H6或N2H4
(任写一个即可).
(3)C有多种氧化物,其中之一是一种无色气体,在空气中迅速变成红棕色,在一定条件下,2L的该无色气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的C的含氧酸盐的化学式是
NaNO2
NaNO2
.





 阅读快车系列答案
阅读快车系列答案
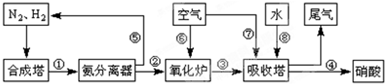
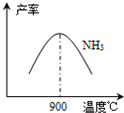 (3)N2和H2在铁作催化剂作用下从145℃就开始反应,不同温度下NH3产率如图所示.温度高于900℃时,NH3产率下降的原因
(3)N2和H2在铁作催化剂作用下从145℃就开始反应,不同温度下NH3产率如图所示.温度高于900℃时,NH3产率下降的原因