
【题目】下列各组离子在溶液中能大量共存,加入OH﹣有沉淀析出,加入H+能放出气体的是( )
A.Na+、C1﹣、NO ![]() 、H+?
、H+?
B.K+、Cl﹣、SO ![]() 、H
、H
C.Fe3+、C1﹣、SO ![]() 、NH
、NH ![]()
D.Ca2+、HCO ![]() 、Cl﹣、NO
、Cl﹣、NO ![]()
 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:
【题目】氟在自然界中常以CaF2的形式存在.
(1)下列关于CaF2的表述正确的是 .
a.Ca2+与F﹣间仅存在静电吸引作用
b.F﹣的离子半径小于Cl﹣ , 则CaF2的熔点高于CaCl2
c.阴阳离子比为2:1的物质,均与CaF2晶体构型相同
d.CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电
(2)CaF2难溶于水,但可溶于含Al3+的溶液中,原因是(用离子方程式表示).
已知AlF63﹣在溶液中可稳定存在.
(3)F2通入稀NaOH溶液中可生成OF2 , OF2分子构型为 , 其中氧原子的杂化方式为
(4)F2与其他卤素单质反应可以形成卤素互化物,例如ClF3、BrF3等.已知反应Cl2(g)+3F2(g)═2ClF3(g)△H=﹣313kJmol﹣1 , F﹣F键的键能为159kJmol﹣1 , Cl﹣Cl键的键能为242kJmol﹣1 , 则ClF3中Cl﹣F键的平均键能为kJmol﹣1 . ClF3的熔、沸点比BrF3的(填“高”或“低”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列仪器:①烧杯;②锥形瓶;③圆底烧瓶;④试管;⑤坩埚;其中可以用酒精灯直接加热的仪器是( )
A. ①②③④ B. ④⑤ C. ①③ D. ④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图所示装置进行实验,并回答下列问题: 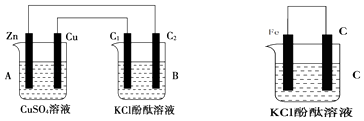
(1)判断装置的名称:A池为 , B池为 .
(2)锌极为极,电极反应式为;石墨棒C1为极,电极反应式为;石墨棒C2附近发生的实验现象为 .
(3)写出C 装置中溶液颜色变红的电极反应式: .
(4)当C2极析出224mL气体(标准状况下)时,CuSO4溶液的质量变化了g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】增塑剂,又称塑化剂,2011年起,台湾被检测出含塑化剂食品已达961项.6月1日卫生部紧急发布公告,将邻苯二甲酸酯(也叫酞酸酯)类物质,列入食品中可能违法添加的非食用物质和易滥用的食品添加剂名单.下列过程就是有机合成某增塑剂的路线:已知:烷基苯在高锰酸钾的作用下,侧链可被氧化成羧基,例如:(图1)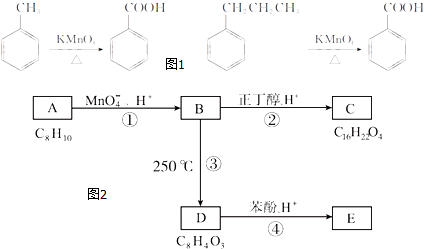
化合物A~E的转化关系如图2所示,已知:A是芳香化合物,只能生成3种一溴化合物,B有酸性,C是常用增塑剂,D是有机合成的重要中间体和常用化学试剂(D也可由其他原料催化氧化得到),E是一种常用的指示剂酚酞.
(1)A的化学名称为 .
(2)B的结构简式为 .
(3)由B生成C的化学方程式为 , 该反应的类型为反应.
(4)D的结构简式为 , 在D物质的核磁共振氢谱图中,会出现组峰,峰面积之比为 .
(5)A的同分异构体中属于芳香族化合物的有种,其中一氯代产物种类最多的是(写结构简式).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是电解CuCl2溶液的装置,其中c、d为石墨电极,则下列有关判断正确的是( ) 
A.a为负极,b为正极
B.d为阳极,c为阴极
C.电解过程中,d电极质量增加
D.电解过程中,氯离子浓度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人类生产、生活中处处都有化学的身影,下列说法正确的是( )
A.燃放焰火必然会发生化学反应,故焰色反应属于某些金属元素的化学性质
B.水蒸气的液化、煤的液化都属于物质状态的改变,都属于物理变化
C.玻璃属于混合物、水玻璃属于纯净物
D.利用厨房中的食醋和纯碱可证明醋酸酸性强于碳酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为
(2)反应是反应.(选填“吸热”、放热).
(3)能判断该反应是否达到化学平衡状态的依据是 .
a.容器中压强不变 b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)c(CH2)=c(CO)c(H2O),试判断此时的温度为℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究铜与浓硫酸的反应,用下图所示装置进行有关实验。请回答:
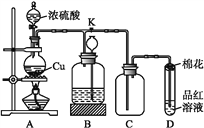
(1)装置A中发生反应的化学方程式为_______________。
(2)装置D中试管口放置的棉花中应浸一种液体,这种液体是_________。
(3)装置B的作用是贮存多余的气体。当D处有明显的现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中长颈漏斗内液面上升,广口瓶内液面下降,则B中应放置的液体是(填字母)___。
a.水 b.酸性KMnO4溶液 c.浓溴水 d.饱和NaHSO3溶液
(4)实验中,取一定质量的铜片和V L 18 mol·L-1硫酸放在圆底烧瓶中共热,直到反应完毕,发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①有一定量的余酸但未能使铜片完全溶解,你认为原因是_____________。
②下列药品中能用来证明反应结束后的烧瓶中确有余酸的是__(填字母)。
A.铁粉 b.BaCl2溶液 c.银粉 d.Na2CO3溶液
③实验结束时测得铜减少了3.2 g,则被还原的硫酸的物质的量为_____mol;转移的电子为_____mol;反应后溶液中硫酸根离子的物质的量浓度为_________mol·L-1。(反应后溶液的体积为V L)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com