
| A. | 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑ | B. | NaOH+HCl═NaCl+H2O | ||
| C. | Fe+CuSO4═Cu+FeSO4 | D. | Fe2O3+3CO $\frac{\underline{\;高温\;}}{\;}$ 2Fe+3CO2 |
科目:高中化学 来源: 题型:选择题
| A. | 用新制的生石灰,通过加热蒸馏,可以除去乙醇中少量的水 | |
| B. | 用酸性高锰酸钾溶液,通过洗气的方法,可以除去甲烷中的乙烯 | |
| C. | 用苯,通过分液的方法,可以除去溴苯中的溴 | |
| D. | 用氢氧化钠溶液,通过分液的方法,可以除去乙酸乙酯中的乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X与Y处于同一周期 | B. | 原子序数:a<b | ||
| C. | a-b=m+n | D. | 离子半径:Xn+>Ym- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 大气臭氧层的反应是:O+O3═2O2△H,该反应的能量变化如图所示,下列叙述中,正确( )
大气臭氧层的反应是:O+O3═2O2△H,该反应的能量变化如图所示,下列叙述中,正确( )| A. | O+O3═2O2是吸热反应 | B. | O+O3═2O2是放热反应 | ||
| C. | 反应O+O3═2O2的△H=E3-E2 | D. | 反应O+O3═2O2的△H=E3-E1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
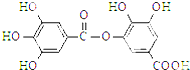
| A. | 能发生碱性水解,1 mol该有机物完全反应消耗8 mol NaOH | |
| B. | 常温下,能与Na2CO3溶液反应放出CO2 | |
| C. | 与稀硫酸共热,能生成两种有机物 | |
| D. | 该有机物的分子式为C14H10O9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
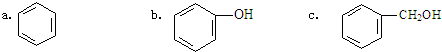
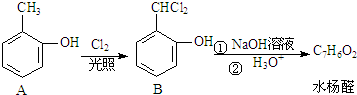
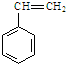 )是一种重要的有机化工原料.
)是一种重要的有机化工原料.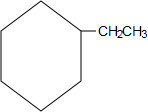 .
.
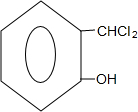 +2NaOH$→_{酸化}^{H_{2}O}$
+2NaOH$→_{酸化}^{H_{2}O}$ +2NaCl+H2O.
+2NaCl+H2O.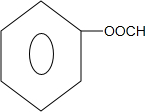 、
、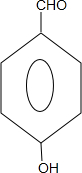 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+、Br2、I2 | B. | I2、Br2、Fe3+ | C. | Br2、Fe3+、I2 | D. | Br2、I2、Fe3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com