
 大气臭氧层的反应是:O+O3═2O2△H,该反应的能量变化如图所示,下列叙述中,正确( )
大气臭氧层的反应是:O+O3═2O2△H,该反应的能量变化如图所示,下列叙述中,正确( )| A. | O+O3═2O2是吸热反应 | B. | O+O3═2O2是放热反应 | ||
| C. | 反应O+O3═2O2的△H=E3-E2 | D. | 反应O+O3═2O2的△H=E3-E1 |
分析 由图可知,O+O3=2O2 的反应为放热反应,△H=E3-E2,利用盖斯定律来分析反应热的关系即可,以此来解答.
解答 解:A、由图可知,反应物O和O3的能量高于产物2O2 的能量,所以反应为放热反应,故A错误;
B、由图可知,反应物O和O3的能量高于产物2O2 的能量,所以反应为放热反应,故B正确;
C、根据焓变的含义△H=产物的焓-反应物的焓,且反应为放热反应,即反应O+O3=2O2的△H=E3-E2,故C正确;
D、根据焓变的含义△H=产物的焓-反应物的焓,且反应为放热反应,即反应O+O3=2O2的△H=E3-E2,故D错误.
故选BC.
点评 本题考查化学反应中的能量变化及盖斯定律,明确信息及图象的分析是解答本题的关键,难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.7 | 9.6 |
| 完全沉淀pH | 3.7 | 4.7 | 11 |
| 温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
| Li2CO3的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
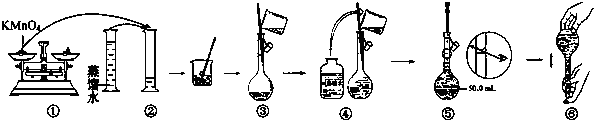
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 色阶序号 | 1 | 2 | 3 | 4 | 5 | 6 |
| 加入溶液B的体积(mL) | 0 | 2.0 | 4.0 | 6.0 | 8.0 | 10.0 |
| 反应后溶液颜色 | 由无色变为由浅到深的樱桃红色 | |||||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑ | B. | NaOH+HCl═NaCl+H2O | ||
| C. | Fe+CuSO4═Cu+FeSO4 | D. | Fe2O3+3CO $\frac{\underline{\;高温\;}}{\;}$ 2Fe+3CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol C3H6Cl2中化学键总数为NA | |
| B. | 42 g乙烯中含碳原子数为3 NA | |
| C. | 标准状况下,1L苯完全燃烧生成的气态产物的分子数为$\frac{6}{22.4}$NA | |
| D. | 0.1 mol乙醇完全燃烧所消耗的氧分子数一定为0.3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
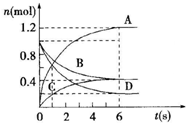 一定温度下,向容积为2L的密闭容器通入两种气体后发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )
一定温度下,向容积为2L的密闭容器通入两种气体后发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )| A. | 该反应的化学方程式为3B+4D═6A+2C | |
| B. | 反应进行到6s时v(B)=v(C) | |
| C. | 反应进行到6s时,用B表示的平均反应速率为0.05mol•L-1•s-1 | |
| D. | 反应进行到6s时,反应停止了 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com