
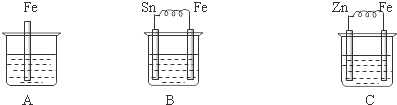
| A. | 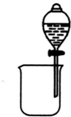 分离碘酒中的碘和酒精 | B. | 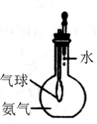 验证氨气易溶于水 | ||
| C. | 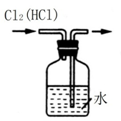 除去Cl2中的HCl杂质 | D. | 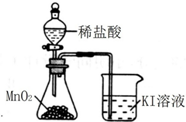 比较MnO2、Cl2、I2 |
分析 A.碘和酒精互溶,不分层;
B.氨气极易溶于水,气球变大;
C.氯气与水反应,HCl极易溶于水;
D.稀盐酸与二氧化锰不反应,与浓盐酸反应还需要加热.
解答 解:A.碘和酒精互溶,不分层,不能利用图中分液法分离,应选蒸馏法,故A错误;
B.氨气极易溶于水,挤压胶头滴管,气球变大,可说明,故B正确;
C.氯气与水反应,HCl极易溶于水,且导管应长进短出,不能除杂,应导管长进短出,试剂为饱和食盐水,故C错误;
D.稀盐酸与二氧化锰不反应,与浓盐酸反应还需要加热,图中不能生成氯气,则不能比较氧化性,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、发生的反应及实验装置的作用为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


科目:高中化学 来源: 题型:多选题
| A. | 上述生成Ni(CO)4(g)的反应为放热反应 | |
| B. | 在80℃时,测得某时刻,Ni(CO)4、CO浓度均为0.5 mol•L-1,则此时v(正)<v(逆) | |
| C. | 恒温恒压下,向容器中再充入少量的Ar,上述平衡将正向移动 | |
| D. | 恒温恒容下,向容器中再充入少量Ni(CO)4(g),达新平衡时,CO 的百分含量将增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3溶液和盐酸;CO32-+2H+═H2O+CO2↑ | |
| B. | 在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3═2FeO42-+3Cl-+H2O+4H+ | |
| C. | 向硫化钠溶液中滴入氯化铝溶液:2Al3++3S2-═Al2S3↓ | |
| D. |  溶液通入少量CO2: 溶液通入少量CO2: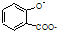 +CO2+H2O→ +CO2+H2O→ +HCO3- +HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
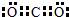 ,Z3+的原子结构示意图为
,Z3+的原子结构示意图为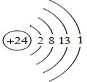
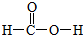 ,m g该物质完全燃烧后通过足量Na2O2固体吸收,Na2O2固体增重的质量为$\frac{15m}{23}$g.
,m g该物质完全燃烧后通过足量Na2O2固体吸收,Na2O2固体增重的质量为$\frac{15m}{23}$g.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某研究小组为探究SO2和Fe(NO3)3溶液的反应的实质.设计了如图所示装置进行实验.已知:1.0mol/L的Fe(NO3)3溶液的pH=1.
某研究小组为探究SO2和Fe(NO3)3溶液的反应的实质.设计了如图所示装置进行实验.已知:1.0mol/L的Fe(NO3)3溶液的pH=1.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
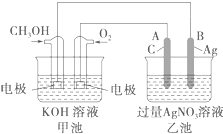
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某雨水样品放置一段时间后pH减小是因为水中溶解的CO2增多 | |
| B. | 雾霾成因与田间焚烧秸秆和燃烧煤炭无关 | |
| C. | SO2能使溴水褪色,也能高锰酸钾溶液褪色,都体现了SO2的漂白性 | |
| D. | 常温下,浓硫酸和浓硝酸可以用铝槽车或铁槽车装运 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (a+0.5b-1.5c)kJ/mol | B. | (a-2.5b+1.5c )kJ/mol | ||
| C. | (2a+3b-2c)kJ/mol | D. | (2c+b-a)kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com