
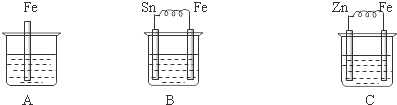
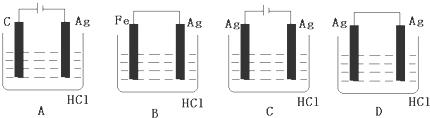
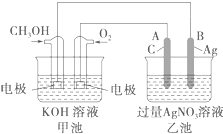
分析 (1)①该装置构成原电池,Fe易失电子作负极、Sn作正极,正极上氢离子得电子发生还原反应而生成氢气,导致氢离子浓度降低;
②作负极的金属>发生化学腐蚀的金属>作正极的金属;
③盐酸和银不能自发的进行氧化还原反应,所以不能设计成原电池,只能设计成电解池,失电子的物质作电解池阳极,金属或导电的非金属作电解池阴极,失电子的物质作电解质溶液;
(2)①由总方程式可知,甲醇被氧化,为原电池的负极,电极的电极反应式是CH3OH-6e-+8OH-═6H2O+CO32-,
②A与原电池正极相连,为电解池的阳极,发生氧化反应;
③甲池中氢氧化钾被消耗,电解质碱性减弱,乙装置电解硝酸银溶液,生成氧气、银和硝酸,所以pH减小.
解答 解:(1)①该装置构成原电池,Fe易失电子作负极、Sn作正极,负极反应式为Fe-2e-=Fe2+,正极上氢离子得电子发生还原反应而生成氢气,电极反应式为2H++2e-=H2↑,导致氢离子浓度降低,溶液的pH增大,故答案为:Fe-2e-=Fe2+;增大;
②金属腐蚀快慢速率:作负极的金属>发生化学腐蚀的金属>作正极的金属,所以铁被腐蚀快慢速率为B>A>C,
故答案为:B>A>C;
③2HCl+2Ag=2AgCl↓+H2↑不能自发进行,所以必须设计成电解池,该反应中银失电子,所以银作电解池阳极,金属或导电的非金属作电解池阴极,该反应中氯化氢得电子生成氢气,则选取盐酸作电解质溶液,所以C选项符合条件,故选C;
(2)①甲为原电池,通入甲醇的一极为原电池的负极,发生氧化反应,电极方程式为CH3OH-6e-+8OH-═CO32-+6H2O,
故答案为:原电;负;CH3OH-6e-+8OH-═CO32-+6H2O;
②乙为电解池,A与原电池正极相连,为电解池的阳极,发生氧化反应,电极方程式为4OH--4e-═O2↑+2H2O,故答案为:电解池;阳;4OH--4e-=O2↑+2H2O;
③甲池中氢氧化钾被消耗,所以碱性减弱,pH降低,乙装置电解硝酸银溶液,阳极生成氧气,阴极生成银,电解总反应式为4Ag++2H2O $\frac{\underline{\;通电\;}}{\;}$4Ag+O2↑+4H+,生成H+,则溶液pH减小,故答案为:减小;减小.
点评 本题考查原电池和电解池的工作原理知识,正确判断正负极并会书写电极反应式,知道金属被腐蚀快慢速率、根据电极反应以及总反应判断溶液pH的变化是重点,题目难度不大.


科目:高中化学 来源: 题型:解答题

| 压强/MPa 温度/℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2% | 99.6% | 99.7% | 99.9% |
| 500 | 93.5% | 96.9% | 97.8% | 99.3% |
| 600 | 73.7% | 85.8% | 89.5% | 96.4% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2(g)+3H2(g)═2NH3(g)△H<0 | B. | 2SO3(g)?═?2SO2(g)+O2(g)△H>0 | ||
| C. | 4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H<0 | D. | H2(g)+CO(g)?═?C(s)+H2O(g)△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 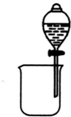 分离碘酒中的碘和酒精 | B. | 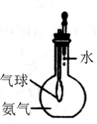 验证氨气易溶于水 | ||
| C. | 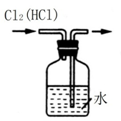 除去Cl2中的HCl杂质 | D. | 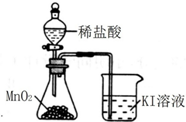 比较MnO2、Cl2、I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 置换反应的通式可用如图表示,单质甲、乙和化合物A、B为中学常见物质,请回答下列问题:
置换反应的通式可用如图表示,单质甲、乙和化合物A、B为中学常见物质,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 肯定不存在的离子是Fe3+、Cu2+、SO42-、CO32-、MnO4-,而是否含NH4+、另需实验验证 | |
| B. | 肯定存在的离子是SO32-、Br-,且Na+、K+离子至少有一种存在 | |
| C. | 无法确定原溶液中是否存在Cl- | |
| D. | 若步骤中Ba(NO3)2和HNO3溶液改用BaCl2和盐酸的混合溶液,则对溶液中离子的判断无影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 汽油、花生油都是油脂 | |
| B. | 碘元素遇淀粉溶液变蓝色 | |
| C. | 合成纤维、玻璃纤维和光导纤维都是有机高分子化合物 | |
| D. | 铵态氮肥不能与草木灰混合施用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 洗涤晶体:向滤出晶体的漏斗中加少量冷水浸没晶体,自然流下,重复2-3次 | |
| B. | 用18mol/L浓硫酸配制溶解所用4mol/L的稀硫酸,玻璃仪器一般只有3种 | |
| C. | 利用Cu(OH)2替代CuO也可调试溶液pH,不影响实验结果 | |
| D. | 若要测定所得硫酸铜晶体中结晶水的数目,在实验中要用到坩埚和坩埚钳 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配位体是Cl-和H2O,配位数是8 | |
| B. | 中心离子是Ti4+,配离子是[TiCl(H2O)5]2+ | |
| C. | 内界和外界中的Cl-的数目比是1:2 | |
| D. | 在1mol该配合物中加入足量AgNO3溶液,可以得到3molAgCl沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com