

| A. | 肯定不存在的离子是Fe3+、Cu2+、SO42-、CO32-、MnO4-,而是否含NH4+、另需实验验证 | |
| B. | 肯定存在的离子是SO32-、Br-,且Na+、K+离子至少有一种存在 | |
| C. | 无法确定原溶液中是否存在Cl- | |
| D. | 若步骤中Ba(NO3)2和HNO3溶液改用BaCl2和盐酸的混合溶液,则对溶液中离子的判断无影响 |
分析 无色溶液中一定不存在有色的Cu2+、MnO4-;用pH试纸检验该溶液,溶液的pH>7,该溶液呈碱性,则一定不存在NH4+、,往该溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成,则原溶液中一定不存在SO42-;另取少量原溶液,加入氯水后生成无色气体,该气体为二氧化碳,则原溶液中一定含有CO32-;加入四氯化碳分液后下层为橙色,则原溶液中一定含有Br-,上层溶液加入硝酸和硝酸钡,有白色沉淀生成,由于原溶液中不存在硫酸根离子,则一定存在SO32-;由于加入了氯水,无法判断是否含有氯离子,据此进行判断.
解答 解:无色溶液中一定不存在有色的Cu2+、MnO4-;用pH试纸检验该溶液,溶液的pH>7,该溶液呈碱性,则不存在NH4+、,往该溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成,则原溶液中一定不存在SO42-;另取少量原溶液,加入氯水后生成无色气体,该气体为二氧化碳,则原溶液中一定含有CO32-;加入四氯化碳分液后下层为橙色,则原溶液中一定含有Br-,上层溶液加入硝酸和硝酸钡,有白色沉淀生成,由于原溶液中不存在硫酸根离子,则一定存在SO32-;由于加入了氯水,无法判断是否含有Cl-,
A.根据分析可知,原溶液中一定含有CO32-,故A错误;
B.肯定存在的离子为:SO32-、Br-,根据溶液电中性可知原溶液中Na+、K+离子至少有一种存在,故B正确;
C.由于加入了氯水,引进了氯离子,则无法确定原溶液中是否含有氯离子,故C正确;
D.加入Ba(NO3)2和HNO3溶液目的是检验硫酸根离子,若改用BaCl2和盐酸的混合溶液,对溶液中离子的判断无影响,故D正确;
故选A.
点评 本题考查了常见离子的检验方法,题目难度中等,明确常见离子的性质为解答关键,注意熟练掌握常见离子的检验方法,试题培养了学生的分析能力及逻辑推理能力.


科目:高中化学 来源: 题型:选择题
| A. | pH=7的溶液呈中性 | |
| B. | pH值为0的溶液中c(H+)=0 mol/L | |
| C. | pH=5的溶液中[H+]=1.0×10-5 mol•L-1 | |
| D. | pH=5的溶液中[OH-]=1.0×10-9 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
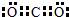 ,Z3+的原子结构示意图为
,Z3+的原子结构示意图为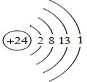
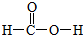 ,m g该物质完全燃烧后通过足量Na2O2固体吸收,Na2O2固体增重的质量为$\frac{15m}{23}$g.
,m g该物质完全燃烧后通过足量Na2O2固体吸收,Na2O2固体增重的质量为$\frac{15m}{23}$g.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某研究小组为探究SO2和Fe(NO3)3溶液的反应的实质.设计了如图所示装置进行实验.已知:1.0mol/L的Fe(NO3)3溶液的pH=1.
某研究小组为探究SO2和Fe(NO3)3溶液的反应的实质.设计了如图所示装置进行实验.已知:1.0mol/L的Fe(NO3)3溶液的pH=1.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
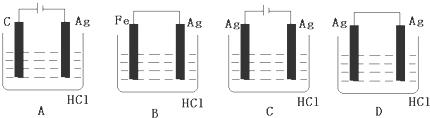
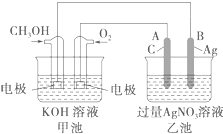
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
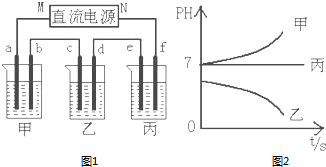 A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
A、B、C三种强电解质,它们在水中电离出的离子如下表所示:| 阳离子 | Ag+ Na+ |
| 阴离子 | NO3- SO42- Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某雨水样品放置一段时间后pH减小是因为水中溶解的CO2增多 | |
| B. | 雾霾成因与田间焚烧秸秆和燃烧煤炭无关 | |
| C. | SO2能使溴水褪色,也能高锰酸钾溶液褪色,都体现了SO2的漂白性 | |
| D. | 常温下,浓硫酸和浓硝酸可以用铝槽车或铁槽车装运 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
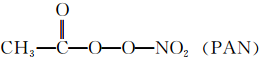 等二次污染物.
等二次污染物.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
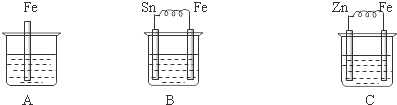
| A. | 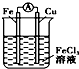 装置是原电池,总反应是:Cu+2Fe3+═Cu2++2Fe2 | |
| B. |  装置研究的是金属的析氢腐蚀,Fe上的反应为Fe-2e-═Fe2+ | |
| C. | 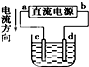 若用装置精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液 | |
| D. | 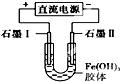 装置通电一段时间后石墨Ⅱ电极附近溶液红褐色加深 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com