
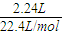 =0.1mol,浓硫酸增重4.05g,为水的质量,则n(H)=2×
=0.1mol,浓硫酸增重4.05g,为水的质量,则n(H)=2×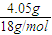 =0.45mol,m(H)=0.45g,
=0.45mol,m(H)=0.45g,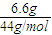 =0.15mol,m(C)=0.15mol×12g=1.8g,
=0.15mol,m(C)=0.15mol×12g=1.8g,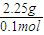 =22.5g/mol,摩尔质量小于22.5g/mol的烃只有甲烷,则混合气体中一定含有甲烷,
=22.5g/mol,摩尔质量小于22.5g/mol的烃只有甲烷,则混合气体中一定含有甲烷,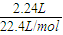 =0.1mol,浓硫酸增重4.05g,为水的质量,则n(H)=2×
=0.1mol,浓硫酸增重4.05g,为水的质量,则n(H)=2×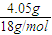 =0.45mol,m(H)=0.45g,
=0.45mol,m(H)=0.45g,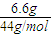 =0.15mol,m(C)=0.15mol×12g=1.8g,
=0.15mol,m(C)=0.15mol×12g=1.8g,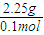 =22.5g/mol,摩尔质量小于22.5g/mol的烃只有甲烷,则混合气体中一定含有甲烷,
=22.5g/mol,摩尔质量小于22.5g/mol的烃只有甲烷,则混合气体中一定含有甲烷,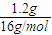 =0.075mol,
=0.075mol,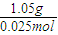 =42,
=42,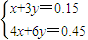
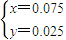 ,
,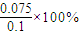 =75%;φ(CH3CH=CH2)=
=75%;φ(CH3CH=CH2)=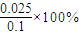 =25%,
=25%,

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:

| 醇 |
| △ |
| 醇 |
| △ |
| 水 |
| △ |
| 水 |
| △ |


查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 (1)甲物质只含有碳、氢两种元素,在标准状况下为气态,有机物甲的产量可以用来衡量一个国家的石油化工发展水平.工业上可以用丙物质来生产甲物质,反应式表示:
(1)甲物质只含有碳、氢两种元素,在标准状况下为气态,有机物甲的产量可以用来衡量一个国家的石油化工发展水平.工业上可以用丙物质来生产甲物质,反应式表示:| 500℃ |
| Cu或Ag |
| △ |
| Cu或Ag |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
(2)若把0.1 mol铁粉和1.6 g硫粉均匀混合后,铺在石棉网上用酒精灯加热引燃。完全反应后,将残渣全部放入过量的稀H2SO4中充分反应,结果所产生的气体体积在标准状况下明显少于2.24 L。其原因是 。?
查看答案和解析>>
科目:高中化学 来源:2009-2010学年四川省达州市渠县二中高三(上)月考化学试卷(9月份)(解析版) 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com