
【题目】下列说法正确的是:(NA表示阿伏加德罗常数的值)( )
A.28g氮气所含有的原子数目为NA
B.6g金属镁变成镁离子时失去的电子数目为为NA
C.标准状况下,22.4L任何气体所含分子数都约为NA
D.50mL 1mol/L NaCl溶液所含的Cl﹣物质的量0.5NA
【答案】C
【解析】
试题分析:A.依据n=![]() 计算物质的量结合分子式计算原子数;
计算物质的量结合分子式计算原子数;
B.依据n=![]() 计算物质的量,结合镁最外层电子数为2分析;
计算物质的量,结合镁最外层电子数为2分析;
C.标准状况下,22.4L任何气体所含分子的物质的量为1mol;
D.根据n=cV,进行计算求解.
解:A.依据n=![]() 计算物质的量=
计算物质的量=![]() =1mol,结合分子式计算原子数为2NA,故A错误;
=1mol,结合分子式计算原子数为2NA,故A错误;
B.依据n=![]() 计算物质的量=
计算物质的量=![]() =0.25mol,结合镁最外层电子数为2,6g金属镁变成镁离子时失去的电子数目为0.5NA,故B错误;
=0.25mol,结合镁最外层电子数为2,6g金属镁变成镁离子时失去的电子数目为0.5NA,故B错误;
C.标准状况下,22.4L任何气体所含分子的物质的量为1mol,所以分子数约为NA,故C正确;
D.n=cV=0.05×1=0.05mol,故D错误;
故选C.


科目:高中化学 来源: 题型:
【题目】根据元素周期表和周期律分析下面推断错误的是
A. 铍原子失电子能力比镁弱
B. HI比砹的氢化物稳定
C. 氢氧化铝碱性比氢氧化镁强
D. 高氯酸的酸性比硫酸强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于资源开发利用的说法,不正确的是
A.石油经分馏后得到的汽油是纯净物
B.煤的干馏是复杂的物理化学变化,石油分馏是物理变化
C.从海水中得到无水MgCl2,电解熔融MgCl2制取金属镁
D.天然油脂是混合物,所以天然油脂没有固定的熔点和沸点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向紫色石蕊试液中加入Na2O2粉末,振荡,正确的叙述是( )
A.最后溶液变蓝
B.溶液先变蓝最后褪色
C.溶液仍为紫色
D.因为Na2O2与石蕊发生氧化还原反应而无气泡产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年8月12日天津港特大爆炸事故,再一次引发了人们对环境问题的关注。据查危化仓库中存有大量的钠、钾、白磷(P4)、硝酸铵和氰化钠(NaCN)。爆炸事故中,因爆炸冲击导致氰化钠泄漏,可以通过喷洒双氧水或硫代硫酸钠溶液来处理,以减轻污染。
资料:氰化钠白色结晶颗粒、易潮解、有微弱的苦杏仁气味、剧毒、易溶于水、易水解生成氰化 氢、水溶液呈碱性。
(1)白磷有毒,能和氯酸溶液发生氧化还原反应:3P4 +10HC1O3 +18H2 O=10HC1+12H3 PO4,该反应的氧化产物是 ,若有1 mo1 P4参加反应转移电子为 mol。
(2)氰化钠(NaCN)是一种化工原料,用于基本化学合成、电镀、冶金和有机合成医药、农药及金属处理等方面。
①已知:25℃时,HCN的电离平衡常数Ka = 6.2×10-10,H2CO3在25℃时的电离平衡常数是Ka1=4.5×10-7 Ka2=4.7×10-11,则向NaCN溶液通入少量CO2反应方程式是: 。
②常温下,氰化钠能与过氧化氢溶液反应,生成碳酸氢钠和能使湿润的红色石蕊试纸变蓝色的气体,大大降低其毒性。该反应的化学方程式是: 。
(3)实验室通过如图所示装置制备Na2SO3。

装置a中盛装Na2SO3固体的仪器名称是 ;装置b的作用是 。
(3)装置c中的产物有Na2S2O3和CO2气体等,实验结束后,装置d中的溶质有NaOH、Na2CO3,还可能有 。
(4)实验结束后,在e处最好连接盛 (选填“NaOH溶液”、“水”、“CC14”中任一种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图中的实验装置制取乙炔。

(1)制取乙炔的化学方程式是 .
(2)乙炔通入酸性KMnO4溶液中观察到的现象是 ,乙炔发生了 反应。
(3)乙炔通入溴的CCl4溶液中乙炔发生了 反应。
(4) 将21g CH4和C2H2的混合气体通入盛有足量溴水的容器中,溴水的质量增加了13g,则混合气体中CH4与C2H2的体积比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四个试管中,过氧化氢分解产生氧气的反应速率最大的是( )
试管 | 温度 | 过氧化氢溶液浓度 | 催化剂 |
A | 常温 | 3% | ﹣﹣ |
B | 水浴加热 | 3% | ﹣﹣ |
C | 水浴加热 | 6% | MnO2 |
D | 常温 | 6% | ﹣﹣ |
A.A B.B C.C D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. HNO3是挥发性一元酸
B. Al2O3是金属氧化物、也是碱性氧化物
C. 氧气和臭氧的相互转化是物理变化
D. 利用过滤法可把Fe(OH)3胶体从FeCl3溶液中分离出来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在已经发现的一百多种元素中,除稀有气体外,非金属元素只有十多种,但与生产生活有密切的联系。
(1)为了提高煤的利用率,常将其气化为可燃性气体,主要反应是碳和水蒸气反应生成
水煤气,化学反应方程式为 。
(2)氮是动植物生长不可缺少的元素,合成氨的反应对人类解决粮食问题贡献巨大,反
应如下:N2(g)+3H2(g)![]() 2NH3(g)。
2NH3(g)。
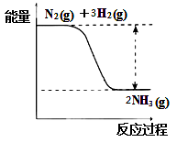
①合成氨的反应中的能量变化如右图所示。
该反应是 反应(填“吸热”或“放热”),其原因是反应物化学键断裂吸收的总能量 (填“大于”或“小于”)生成物化学键形成放出的总能量。
②在一定条件下,将一定量的N2和H2的混合气体充入某定容密闭容器中,一段时间后,下列叙述不能说明该反应达到平衡状态的是 (填序号)。
A.容器中混合气体的密度不随时间变化
B.单位时间内断裂3 mol H-H键的同时断裂6 mol N-H键
C. N2 、H2 、NH3的物质的量之比为1:3:2
D.容器中混合气体的平均相对分子质量不随时间变化
(3)目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)
+3H2(g)![]() CH3OH(g)+H2O(g),在体积为1 L的密闭容器中,充入1 molCO2和3 molH2,测得CO2和CH3OH(g)的浓度随时间变化如下图所示。
CH3OH(g)+H2O(g),在体积为1 L的密闭容器中,充入1 molCO2和3 molH2,测得CO2和CH3OH(g)的浓度随时间变化如下图所示。
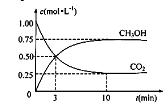
①从反应开始到平衡,用氢气浓度变化表示的平均反应速率v (H2)= 。
②达平衡时容器内平衡时与起始时的压强之比 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com