
【题目】在已经发现的一百多种元素中,除稀有气体外,非金属元素只有十多种,但与生产生活有密切的联系。
(1)为了提高煤的利用率,常将其气化为可燃性气体,主要反应是碳和水蒸气反应生成
水煤气,化学反应方程式为 。
(2)氮是动植物生长不可缺少的元素,合成氨的反应对人类解决粮食问题贡献巨大,反
应如下:N2(g)+3H2(g)![]() 2NH3(g)。
2NH3(g)。
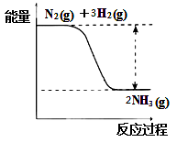
①合成氨的反应中的能量变化如右图所示。
该反应是 反应(填“吸热”或“放热”),其原因是反应物化学键断裂吸收的总能量 (填“大于”或“小于”)生成物化学键形成放出的总能量。
②在一定条件下,将一定量的N2和H2的混合气体充入某定容密闭容器中,一段时间后,下列叙述不能说明该反应达到平衡状态的是 (填序号)。
A.容器中混合气体的密度不随时间变化
B.单位时间内断裂3 mol H-H键的同时断裂6 mol N-H键
C. N2 、H2 、NH3的物质的量之比为1:3:2
D.容器中混合气体的平均相对分子质量不随时间变化
(3)目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)
+3H2(g)![]() CH3OH(g)+H2O(g),在体积为1 L的密闭容器中,充入1 molCO2和3 molH2,测得CO2和CH3OH(g)的浓度随时间变化如下图所示。
CH3OH(g)+H2O(g),在体积为1 L的密闭容器中,充入1 molCO2和3 molH2,测得CO2和CH3OH(g)的浓度随时间变化如下图所示。
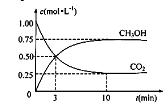
①从反应开始到平衡,用氢气浓度变化表示的平均反应速率v (H2)= 。
②达平衡时容器内平衡时与起始时的压强之比 。
【答案】(1)C(s)+H2O(g) ![]() CO (g)+ H2(g)
CO (g)+ H2(g)
(2)① 放热 小于 ② AC
(3) 0.225mol/(L.min); 5:8
【解析】
试题分析:(1)碳和水蒸气反应生成CO和H2,化学反应方程式为C(s)+H2O(g) ![]() CO (g)+ H2(g);(2)①合成氨的反应中生成物的总能量小于反应物的总能量,该反应是放热反应,其原因是反应物化学键断裂吸收的总能量小于生成物化学键形成放出的总能量。
CO (g)+ H2(g);(2)①合成氨的反应中生成物的总能量小于反应物的总能量,该反应是放热反应,其原因是反应物化学键断裂吸收的总能量小于生成物化学键形成放出的总能量。
②在一定条件下,将一定量的N2和H2的混合气体充入某定容密闭容器中,一段时间后,下列叙述不能说明该反应达到平衡状态的是AC。
A.根据![]() ,密度是恒量,容器中混合气体的密度不随时间变化,不一定平衡;
,密度是恒量,容器中混合气体的密度不随时间变化,不一定平衡;
B.单位时间内断裂3 mol H-H键的同时断裂6 mol N-H键,一定平衡;
C. N2 、H2 、NH3的物质的量之比为1:3:2,不一定平衡;
D.根据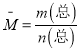 ,n(总)是变量,容器中混合气体的平均相对分子质量不随时间变化,一定平衡;
,n(总)是变量,容器中混合气体的平均相对分子质量不随时间变化,一定平衡;
(3) ①由图2可知,10min达平衡时甲醇的浓度变化量为0.75mol/L,所以v(CH3OH)=
![]() =0.075mol/(L·min),速率之比等于化学计量数之比,所以v(H2)=3v(CH3OH)=3×0.075mol/(L·min)=0.225mol/(L·min)。
=0.075mol/(L·min),速率之比等于化学计量数之比,所以v(H2)=3v(CH3OH)=3×0.075mol/(L·min)=0.225mol/(L·min)。
②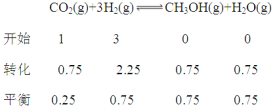
达平衡时容器内平衡时与起始时的压强之比(0.25+0.75+0.75 +0.75):4=5:8。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是:(NA表示阿伏加德罗常数的值)( )
A.28g氮气所含有的原子数目为NA
B.6g金属镁变成镁离子时失去的电子数目为为NA
C.标准状况下,22.4L任何气体所含分子数都约为NA
D.50mL 1mol/L NaCl溶液所含的Cl﹣物质的量0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组顺序的排列正确的是( )
A. 最高正化合价:F>O>N>C
B. 离子半径:F->O2->Na+>Al3+
C. 热稳定性:PH3<H2S<HCl<HF
D. 单质的还原性:Al>Mg>Na>K
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 (10分)研究催化剂对化学反应有重要意义。为探究催化剂对双氧水分解的催化效果,某研究小组做了如下实验:
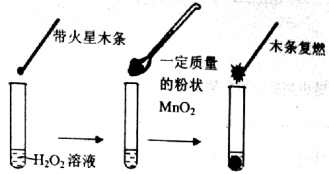
(1)甲同学欲用上图所示实验来证明MnO2是H2O2分解反应的催化剂。该实验______(填“能”或“不能”)达到目的,原因是_____________。(若能,不必回答原因)
(2)为分析Fe3+和Cu2+对H2O2分解反应的催化效果,丙同学设计如下实验(三支试管中均盛有10mL5%H2O2)

由此得到的结论是__________,设计实验Ⅲ的目的是__________。
(3)在上述实验过程中,分别检测出溶液中有二价铁生成,查阅资料得知:将作为催化剂的FeCl3溶液加入H2O2溶液后,溶液中会发生两个氧化还原反应,且两个反应中H2O2均参加了反应,试从催化剂的角度分析,这两个氧化还原反应的化学方程式分别是__________和__________(按反应发生的顺序写)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维生素是构成生命的基础物质.在鸡蛋、蔬菜、大米等食物中,富含维生素的是 .“84消毒液”在日常生活中被广泛使用.该消毒液无色,对某些有色物质具有漂白作用,它的有效成分是 (填“KMnO4”或“NaClO“).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是四种短周期元素,E是过渡元素.A、B、C同周期,C、D同主族,A的原子结构示意图为:![]() ,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2.回答下列问题:
(1)写出下列元素的符号:A B C D
(2)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是 ,碱性最强的是 .
(3)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是 ,电负性最大的元素是 .
(4)D的氢化物比C的氢化物的沸点 (填“高“或“低“),原因
(5)E元素原子的核电荷数是 ,E元素在周期表的位置 .
(6)A、B、C最高价氧化物的晶体类型是分别是 晶体、 晶体、 晶体
(7)画出D原子的核外电子轨道表示式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与有机物的结构、性质有关的说法正确的是( )
A.C5H12属于烷烃且有2种同分异构体
B.乙烯、氯乙烯、甲苯分子中的所有原子均共平面
C.C4H10与Cl2在光照条件下反应,可生成4种一氯代烃
D.苯分子中不含碳碳双键,所以不能发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】太阳能光伏发电系统是被称为“21世纪绿色光源”的半导体照明(LED)系统(如图)。已知发出白光的LED是将GaN芯片和钇铝石榴石(YAG,化学式:Y3Al5O12)芯片封装在一起做成。下列说法中不正确的是( )
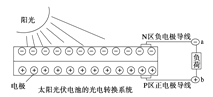
A. 光伏发电是将太阳能转变为电能
B. Ga与N在元素周期表中不处于同一主族
C. YAG中钇显+3价
D. 上图中N区半导体为负极,P区半导体为正极,电流从a流向b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SF6是一种优良的绝缘气体,分子结构中存在S-F键.已知1molS(s)转化为气态硫原子吸收能量280kJ,断裂1molF-F、S-F键需吸收的能量分别为160kJ、330kJ。则发生反应S(s)+3F2(g)═SF6(g),生成1molSF6时能量变化为( )
A. 释放1220KJ B. 吸收1780KJ C. 吸收1220KJ D. 释放1780KJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com