
【题目】胶体和溶液的本质区别是_____,区分胶体和溶液的现象叫做________现象。
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:
【题目】有如下有机物:(每空一分)
① ![]() ②
② ![]() ③
③ ![]() ④CH3CH=CHCH3 ⑤
④CH3CH=CHCH3 ⑤ ![]() ⑥
⑥ ![]() ⑦
⑦ ![]()
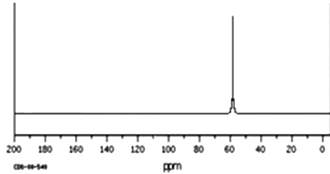
(1)互为同分异构体的是: , 存在手性异构体的是: , 存在顺反异构体的是 , 互为同系物的是(任写一对):;
(2)氢核磁共振(1H﹣NMR)图谱如上图所示的有;
(3)上述物质中,不属于同分异构体,相同质量时,在氧气中完全燃烧消耗的氧气的质量完全相同的烃是:;
(4)有机物④的系统命名法名称是;
(5)有机物⑤的键线式 , 其分子中碳原子杂化.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、碳都是重要的非金属元素,含氮、碳元素的物质在工业生产中有重要的应用.
(1)请写出工业上由NH3制取NO的化学方程式 .
(2)一定条件下,铁可以和CO2发生反应:Fe(s)+CO2(g)FeO(s)+CO(g),已知该反应的平衡常数K与温度T的关系如图所示.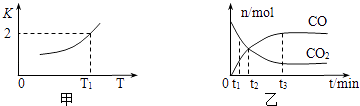
①该反应的逆反应是(填“吸热”或“放热”)反应.
②T℃、P pa压强下,在体积为VL的容器中进行反应,下列能说明反应达到平衡状态的是 .
A、混合气体的平均相对分子质量不再变化;
B、容器内压强不再变化;
C、v正(CO2)=v逆(FeO)
③T1温度下,向体积为V L的密闭容器中加入足量铁粉并充入一定量的CO2 , 反应过程中CO和CO2物质的量与时间的关系如图乙所示.则CO2的平衡转化率为 , 平衡时混合气体的密度与起始时气体的密度之比为 .
(3)在恒温条件下,起始时容积均为5L的甲、乙两密闭容器中(甲为恒容容器、乙为恒压容器),均进行反应:N2+3H22NH3 , 有关数据及平衡状态特定见表.
容器 | 起始投入 | 达平衡时 | |||
甲 | 2mol N2 | 3mol H2 | 0mol NH3 | 1.5mol NH3 | 同种物质的体积分数相同 |
乙 | a mol N2 | b mol H2 | 0mol NH3 | 1.2mol NH3 | |
起始时乙容器中的压强是甲容器的倍.
(4)一定条件下,2.24L(折算为标准状况)N2O和CO的混合气体在点燃条件恰好完全反应,放出bkJ热量.生成的3种产物均为大气组成气体,并测得反应后气体的密度是反应前气体密度的 ![]() 倍.请写出该反应的热化学方程式 .
倍.请写出该反应的热化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于碱金属的说法不正确的是 ( )
A. 原子最外层电子数都是1
B. 单质的熔点随着原子序数的递增而增大
C. 原子半径随着原子序数的递增而增大
D. 单质与氧气都能反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室安卡因(G)是一种抗心律失常药物,可由下列路线合成: 
(1)Ⅰ.已知A是 ![]() 的单体.则A中所含官能团的名称是 .
的单体.则A中所含官能团的名称是 .
(2)写出B的结构简式并用系统命名法给C命名: B: , C的名称: .
(3)L是E的向分异构体,L分子中含有苯环且苯环上一氯代物只有两种,则L所有可能的结构简式有 ![]() 、、、 .
、、、 .
(4)F→G的反应类型是 .
(5)下列关于室安卡因(G)的说法正确的是 a.能发生加成反应 b.能使酸性高锰酸钾溶液褪色
c.能与盐酸反应生成盐 d.属于氨基酸
(6)写出C与足量NaOH醇溶液共热时反应的化学方程式: .
(7)Ⅱ.H是C的同系物,其核磁共振氢谱有两个峰.按如下路线,由H可合成高聚物V: 
H的结构简式为;N→Q的反应类型为 .
(8)写出Q→V的反应方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】澳大利亚研究人员最近开发出被称为第五形态的固体碳,这种新的碳结构称作“纳米泡沫”,他外形类似海绵,比重极小,并具有磁性。纳米泡沫碳与金刚石的关系是
A. 同系物B. 同分异构体C. 同位素D. 同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于周期表中下列位置的①~⑩十种元素,根据有关要求回答:
(1)能形成共价键的元素共有种。
(2)只需形成一个共价单键就能达到稳定结构的元素有(填元素符号)。
(3)气态氢化物溶于水生成的呈碱性的化合物是(填化学式)。
(4)⑩号元素最高正价含氧酸只含有键。
(5)①⑤⑦形成的化合物的电子式为。
(6)某元素的气态氢化物为H2B,其最高价氧化物中B的质量分数为40%,则其气态氢化物的电子式为 , 它与③的化合物的分子式为 , 含有的化学键类型有。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E代表五种元素。A元素的三价离子3d能级处于半充满;B元素原子的最外层电子数是内层电子总数的2倍;C的原子轨道中有2个未成对的电子,且与B可形成两种常见的气体;D的原子序数小于A,D与C可形成DC2和DC3两种分子,且DC2是极性分子,DC3是非极性分子;E是短周期元素中除了稀有气体外原子半径最大的元素。试回答下列问题:
(1)写出A元素基态原子的电子排布式。
(2)B、C、D三种元素的电负性由大到小的顺序为(写元素符号)。
(3)E与C以1:1形成的物质的电子式为。
(4)用VSEPR理论判断DC3分子的空间立体结构为。
(5)元素周期表中第一电离能最大的元素是(填元素符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置应用于实验室制氯气并回收氯化锰的实验,已知氯化锰可溶于水,二氧化锰难溶于水,能达到实验目的的是:( )
A.用装置甲制取氯气
B.用装置乙吸收实验过程中制取的多余的氯气
C.用装置丙分离二氧化锰和氯化锰溶液
D.用装置丁除去氯气中的少量氯化氢
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com