
【题目】已知A、B、C、D、E代表五种元素。A元素的三价离子3d能级处于半充满;B元素原子的最外层电子数是内层电子总数的2倍;C的原子轨道中有2个未成对的电子,且与B可形成两种常见的气体;D的原子序数小于A,D与C可形成DC2和DC3两种分子,且DC2是极性分子,DC3是非极性分子;E是短周期元素中除了稀有气体外原子半径最大的元素。试回答下列问题:
(1)写出A元素基态原子的电子排布式。
(2)B、C、D三种元素的电负性由大到小的顺序为(写元素符号)。
(3)E与C以1:1形成的物质的电子式为。
(4)用VSEPR理论判断DC3分子的空间立体结构为。
(5)元素周期表中第一电离能最大的元素是(填元素符号)。
【答案】
(1)1s22s22p63s23p63d64s2
(2)O>S>C
(3)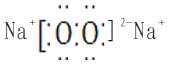
(4)正三角形
(5)He
【解析】A元素的三价离子3d能级处于半充满,即为3d5 , 则它的原子价电子构型为3d64s2 , 故为Fe元素;由“B元素原子的最外层电子数是内层电子总数的2倍”推出,B为C元素;由“C的原子轨道中有2个未成对的电子,且与B可形成两种常见的气体”推出,C为O元素;由“D的原子序数小于A,D与C可形成DC2和DC3两种分子,且DC2是极性分子,DC3是非极性分子”推出,D为S元素;由“E是短周期元素中除了稀有气体外原子半径最大的元素”可推出,E为Na元素。(1)A元素基态原子的电子排布式为1s22s22p63s23p63d64s2。(2)B、C、D分别对应的是C、O、S元素,它们的电负性由大到小的顺序为O>S>C。(3)E与C以1:1形成的物质是Na2O2。(4)根据VSEPR理论 ![]() =3,故SO3的空间立体结构为正三角形。(5)在元素周期表中第一电离能最大的元素是He。
=3,故SO3的空间立体结构为正三角形。(5)在元素周期表中第一电离能最大的元素是He。


科目:高中化学 来源: 题型:
【题目】下列有关实验原理、方法和结论都正确的是( )
A.向饱和FeCl3溶液中滴加过量氨水,可制取Fe(OH)3胶体
B.取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+
C.向某无色溶液中加入稀盐酸无现象,再加入BaCl2溶液产生白色沉淀,证明含SO42ˉ
D.已知I3﹣![]() I2+I﹣ , 向盛有KI3溶液的试管中加入适量CCl4 , 振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大
I2+I﹣ , 向盛有KI3溶液的试管中加入适量CCl4 , 振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧是地壳中含量最多的元素,据此回答问题。
(1)氧元素基态原子核外未成对电子数为。
(2)H2O分子内的O—H键、分子间的范德华力和氢键从强到弱依次为。 的沸点比
的沸点比 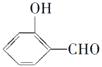 高,原因是 .
高,原因是 .
(3)H+可与H2O形成H3O+ , H3O+中O原子采用杂化。H3O+中H—O—H键角比H2O中H—O—H键角大,原因为。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列属于碱性甲醇燃料电池的正极反应,且电极反应式书写正确的是( )
A. CH3OH-6e-=CO2↑+2H2OB. O2+4e-+2H2O=4OH-
C. CH3OH+6e-=CO32-+4OH-D. O2+4e-=2O2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由乙烯推测丙烯(CH2=CH﹣CH3)的结构或性质正确的是( )
A.不能使酸性高锰酸钾溶液褪色
B.不能在空气中燃烧
C.能使溴水褪色
D.与HCl在一定条件下能加成只得到一种产物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com