
| A.氨水中沉淀一定比NaOH溶液中的多 |
| B.氨水中沉淀一定比NaOH溶液中的少 |
| C.氨水中沉淀可能比NaOH溶液中的多 |
| D.氨水中和NaOH溶液中的沉淀不可能一样多 |


科目:高中化学 来源:不详 题型:问答题
| | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀时 | 3.4 | 6.3 | 2.7 |
| 完全沉淀时 | 5.2 | 9.7 | 3.2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.3 mol·L-1 HCl溶液 | B.4 mol·L-1 HNO3溶液 |
| C.8 mol·L-1 NaOH溶液 | D.18 mol·L-1 H2SO4溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
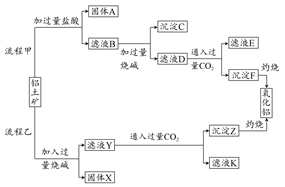
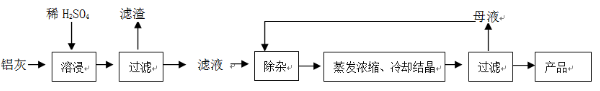
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
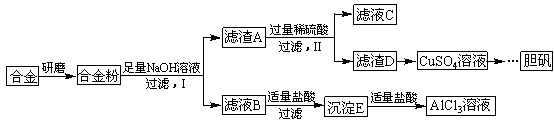
 2CuO,CuO+H2SO4=CuSO4+H2O
2CuO,CuO+H2SO4=CuSO4+H2O CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
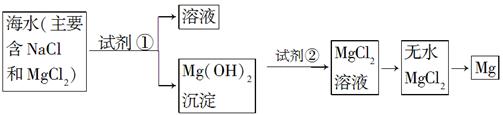
| 方法 | 是否正确 | 简述理由 |
| 方法1:直接往海水中加入沉淀剂 | 不正确 | (一) |
| 方法2:高温加热蒸发海水后,再加入沉淀剂 | (二) | (三) |
| 你认为最合理的其他方法是: (四) | ||
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 第一份 | 加入0.5 g水 | 很快产生火花 |
| 第二份 | 加入1 g胆矾 | 约需30 s产生火花 |
| 第三份 | 加入1 g无水硫酸铜 | 1 min时仍没有明显反应现象 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com