
溶液中由水电离产生的c(OH﹣)=1×10﹣14mol•L﹣1,满足此条件的溶液中一定能大量共存的离子组是( )
|
| A. | Al3+ Na+ NO3﹣ Cl﹣ | B. | K+ Ba2+ Cl﹣ NO3﹣ |
|
| C. | K+Na+ Cl﹣CO32﹣ | D. | K+ NH4+ SO42﹣ NO3﹣ |
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:
银氨溶液可用于检测CO气体,实验室研究的装置如图:
|
| 已知:银氨溶液制备反应为 Ag++2NH3·H2O=[Ag(NH3)2]++2H2O。 反应结束后试管C底部有黑色沉淀生成,分离出上层清液和底部黑色固体备用。 |
(1)甲酸(HCOOH)遇浓硫酸分解生成CO和H2O,该反应体现浓硫酸的 (填“强氧化性”或“脱水性”)。
(2)装置A中软管的作用是 。
(3)为验证上层清液中产物的成分,进行如下实验:
a.测得上层清液pH为10。
b.向上层清液中滴加几滴Ba(OH)2溶液,发现有白色浑浊出现,同时产生能使湿润
红色石蕊试纸变蓝的气体。
c.取新制的银氨溶液滴加几滴Ba(OH)2溶液,无明显现象。
①实验c的目的是 。
②根据上述实验现象判断,上层清液中产物成分为 (填化学符号)。
(4)设计实验证明黑色固体的成分是Ag:
可供选择的试剂有:浓硫酸、浓硝酸、NaOH溶液、NaCl溶液。
取少量上述黑色固体,用蒸馏水洗净, ,说明黑色固体是Ag单质。(补充必要的实验内容及实验现象)
(5)从银氨溶液中回收银的方法是:向银氨溶液中加入过量盐酸,过滤,向沉淀AgCl
中加入羟氨(NH2OH),充分反应后可得银,羟氨被氧化为N2。
①写出生成AgCl沉淀的离子反应 。
②若该反应中消耗6.6 g羟氨,理论上可得银的质量为 g。
查看答案和解析>>
科目:高中化学 来源: 题型:
配制0.1mol/L盐酸溶液480mL,用量筒量取密度为1.19g/cm3质量分数为37%的浓盐酸约(取整数)( )mL注入烧杯中。用蒸馏水洗涤烧杯2~3次,将洗涤液注入容量瓶中。
A 3.5 B 3.8 C 2.5 D 4.2
查看答案和解析>>
科目:高中化学 来源: 题型:
能说明醋酸是弱电解质的事实是( )
|
| A. | 醋酸水溶液能使湿润的蓝色石蕊试纸变红 |
|
| B. | 醋酸和碳酸钠溶液反应放出二氧化碳 |
|
| C. | c(H+)相同的醋酸和盐酸相比较,醋酸溶液的浓度大 |
|
| D. | 物质的量浓度和体积均相同的醋酸和盐酸可中和等物质的量的NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
反应P(g)+Q(g)⇌M(g)+N(s)△H<0,达到平衡时,下列说法正确的是( )
|
| A. | 减小容器体积,平衡不移动 | B. | 加入催化剂,M的产率增大 |
|
| C. | 增大c(P),P的转化率增大 | D. | 降低温度,Q的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)⇌2Z(g)△H<0,一段时间后达到平衡,反应过程中测定的数据如下表,下列说法正确的是( )
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
|
| A. | 反应前2min的平均速率v(Z)=2.0×10﹣3mol/(L•min) |
|
| B. | 其他条件不变,降低温度,反应达到新平衡前v(逆)<v(正) |
|
| C. | 该温度下此反应的平衡常数K=144 |
|
| D. | 其他条件不变,再充入0.2mol Z,平衡时X的体积分数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学反应 2A 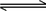 B+D 在四个不同条件下进行.B、D起始为0.反应物A的浓度(mol/L)随反应时间(min)变化情况如下表:
B+D 在四个不同条件下进行.B、D起始为0.反应物A的浓度(mol/L)随反应时间(min)变化情况如下表:
| 实验序号 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
| 1 | 800℃ | 1.0 | 0.8 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | C2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | C3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
根据表中数据完成下列填空:
(1)在实验1,反应在10至20min内的平均速率为 mol/(L.min)
(2)在实验2,A的初始浓度C2= 1.0 mol/L,反应经20min就达到平衡,可推测实验2中还隐含的条件是 .
(3)设实验3的反应速率为υ3,实验1的反应速率为υ1,则υ3 υ1(填“<“,“=“,“>“),且C3 1.0mol/L (填“<“,“>“或“=“).
(4)比较实验4和实验1,可推测该反应 吸热 反应(填“吸热“或”放热“),理由是: .
查看答案和解析>>
科目:高中化学 来源: 题型:
在常温下,发生下列几种反应: ①16H++10Z-+2XO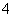 ===2X2++5Z2+8H2O
===2X2++5Z2+8H2O
②2A2++B2===2A3++2B- ③2B-+Z2===B2+2Z-
根据上述反应,下列结论判断错误的是
A.溶液中可发生:Z2+2A2+===2A3++2Z- B.Z2在①③反应中为氧化剂
C.氧化性强弱的顺序为:XO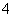 >Z2>B2>A3+ D.X2+是XO
>Z2>B2>A3+ D.X2+是XO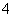 的还原产物
的还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)下列每组物质中都有一种与其它三种不同类,找出这种物质将其化学式写在后面的横线上:
①NaCl、NaI、Na2CO3、NaBr:_________ ②CH3COOH、HCl、HNO3、H2SO4:
③Al(OH)3、Ba(OH)3、Fe(OH)3、NH3·H2O: ④CO2、SO2、CaO、Mn2O7:
(2)同温、同压时质量相等的O2和O3相比较,其物质的量之比为________,体积之比为______
密度之比为________,所含氧原子数之比为_________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com