
����Ŀ����������ʮ�����ʣ��� Һ̬�Ȼ��� ��С�մ��� ���崿�� �� ������̼ ������ �� �������� �������������� �� ��ˮ ������ �� ��������Һ
(1)����ʮ�������У����ڵ���ʵ���_________�����ڷǵ���ʵ���_____________��
(2)������������ˮ��Һ�пɷ�����Ӧ�����ӷ���ʽΪH++OH-=H2O���÷�Ӧ�Ļ�ѧ����ʽΪ_______��
(3)��ȥ�����������IJ�����________����ѧ����ʽΪ_____________��
(4)��״���£�_________L���к���0.4mol��ԭ�ӡ�
(5)����100mL����Һ�к�Fe3+5.6g������Һ��SO42-�����ʵ���Ũ����____________��
���𰸡�(1)�٢ڢۢ����ܢ�
(2)HCl+KOH=KCl+H2O
(3)���ȣ�2NaHCO3![]() Na2CO3+CO2��+H2O
Na2CO3+CO2��+H2O
(4)4.48(5)1.5mol/L
��������
���������(1)����ˮ��������״̬���ܹ�������������ӵĻ������ǵ������������ڵ���ʵ���Һ̬�Ȼ��⡢С�մ��崿��������أ�����ˮ��������״̬�������ܹ�������������ӵĻ����������������������ڷǵ���ʵ��ж�����̼�����ǡ�
(2)������������ˮ��Һ�пɷ�����Ӧ�����ӷ���ʽΪH++OH-=H2O����˵��Ӧ����ǿ���ǿ�Ӧ�����ɿ������Σ���÷�Ӧ�Ļ�ѧ����ʽΪHCl + KOH = KCl + H2O��
(3)̼�����������ֽ�����̼���ƣ�����ȥ�����������IJ��������ȣ���Ӧ����ѧ����ʽΪ2NaHCO3![]() Na2CO3+CO2��+H2O��
Na2CO3+CO2��+H2O��
(4)1molCO2����2mol��ԭ������0.2molCO2����0.4mol��ԭ�ӣ�����״���������Ϊ0.2mol��22.4L/mol��4.48L��
(5)5.6g�����ӵ����ʵ�����0.1mol��������������Ļ�ѧʽ��֪����������ʵ�����0.15mol��Ũ����0.15mol��0.1L��1.5mol/L��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������л�ѧ����������ͬ���ǣ� ��
A.HCl MgCl2 NH4Cl
B.H2O Na2O CO2
C.CaCl2 NaOH H2S
D.NH3 H2O CO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�����Ʊ��������ķ����ǽ�����Ũ�����Ũ����Ļ��Һ���ȵ� 50��60����Ӧ����֪�����������Ļ��������������±���ʾ��


��1��Ҫ����Ũ�����Ũ����Ļ�����ע��������_________________��
��2��������������ˮ�Ļ����ķ�����_____________�������������ͱ��ķ�����_____________��
��3��ijͬѧ����ͼװ����ȡ������:
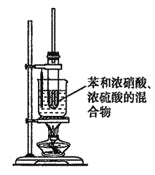
����ˮԡ���ȵ��ŵ���_________________��
����ˮԡ���ȵ��Թܿڲ���Ҫ��һ�����ܣ���������_________________��
��4��д���˷�Ӧ�Ļ�ѧ����ʽ____________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ���������
A. ��ԭ�ӹ�����Ԫ�ص����й�������ӵĹ���֮һ
B. �����ӻ������Dz���������˼���������˶����д��ص�
C. �������۲����ɹ���������ԭ�ӹ��ף����һ��ƹ㵽����ԭ�ӹ���
D. ԭ���е����ھ���ȷ���뾶��Բ�ܹ�������һ��������ת��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ���У���pH��ֽ��ʹ�� ������ ������ ������һ�����ʵ���Ũ����Һ�����õ���������
A. ������ B. ������ C. �Թ� D. ��Һ©��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����6.5 g Zn����500mLϡ�����У�Zn��HCl��ǡ����ȫ��Ӧ�����㣺
��1��6.5 g Zn�����ʵ���_______________��
��2�����ɵ������ڱ�״���µ����_____________��
��3��ԭϡ��������ʵ���Ũ��_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A��H2SO4��H3PO4��Ħ���������
B��2g�������1 mol��
C��O2��Ħ����������ֵ�ϵ�����һ�����ӵ�����
D��1 mol CO��������28 g��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ����ѪҺ���鵥�У�����������ͼ��ʾ�����ָ�ꡣ��ʾ�����ָ�����������
�������� | 0.52 | mmol/L |
�ܵ��̴� | 4.27 | mmol/L |
���ܶ�֬�����̴� | 1.57 | mmol/L |
���ܶ�֬�����̴� | 1.40 | mmol/L |
������ | 4.95 | mmol/L |
A���ܽ�� B�����ʵ���Ũ�� C���������� D��Ħ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڷ�����ѧ�г���Na2C2O4������Ϊ�����ʲⶨKMnO4��Һ��Ũ�ȡ�
��1������W g Na2C2O4���100mL����Һ����ȡ20.00mL������ƿ�У�������KMnO4��ҺӦװ��______��������ʽ��������ʽ�����ζ����У��жϵζ��ﵽ�յ��������_________________��
��2��д��KMnO4���ȵľ������ữ��Na2C2O4��Ӧ����Mn2+��CO2�Ļ�ѧ����ʽ��________________________��
��3��25��ʱ����pH�Ʋ��0.10 mol��L��1��������Һ��pH=a����H2C2O4�ĵڶ�������ƽ�ⳣ��Ka2= ��
��4��CaC2O4��������ˮ�Ĺ��壬�����ֽ⣬��һ���¶�����2L���ܱ��������������������������ռ������Բ�����������Ӧ�� CaC2O4��s��![]() CaO��s��+CO��g��+CO2��g������ǰ5min������CaO������Ϊ16.8g����ö�ʱ��������CO��=__________mol��L��1��s��1������Ӧ�ﵽƽ����������ѹ����ԭ����һ�룬������˵����ȷ����__________�����ѡ��������
CaO��s��+CO��g��+CO2��g������ǰ5min������CaO������Ϊ16.8g����ö�ʱ��������CO��=__________mol��L��1��s��1������Ӧ�ﵽƽ����������ѹ����ԭ����һ�룬������˵����ȷ����__________�����ѡ��������
A��ƽ�ⲻ�ƶ���CaO����������
B��ƽ�ⷢ���ƶ�����CO�İٷֺ�������ʱ�ﵽ�µ�ƽ��
C��ƽ�ⷢ���ƶ�����CO��CO2��Ũ�ȶ�û�иı�
D��ƽ�����淴Ӧ�����ƶ����Ҹ÷�Ӧ�Ļ�ѧƽ�ⳣ����С
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com