
硝酸汞和碘化钾溶液混合后会生成红色的碘化汞沉淀,为了探究硝酸汞和碘化钾溶液之间能否发生氧化还原反应,研究人员设计了如图的实验装置,结果电流计指针发生了偏转,下列分析正确的是( )
| A.如图装置的电流方向是从C1到C2 |
| B.C1是负极,发生的反应是2I-=I2+2e- |
| C.K+离子向C1电极流动 |
| D.装置发生的总反应是Hg2++2I-=HgI2↓ |
科目:高中化学 来源: 题型:单选题
下列叙述正确的是
| A.用饱和NaHCO3溶液可以将混在CO2气体中的HCl除去 |
| B.能使润湿的淀粉KI试纸变蓝的气体一定是Cl2 |
| C.某“海水”电池的总反应为:5MnO2+2Ag+2NaCl==Na2Mn5O10+2AgCl,每生成1 mol Na2Mn5O10转移2 mol电子 |
| D.在铁制品上镀铜时,铁制品作电镀池的阳极,铜盐为电镀液 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
利用生活中常见的材料可以进行很多科学实验,甚至制作出一些有实际应用价值的装置来.下图就是一个用废旧材料制作的可用于驱动玩具的电池的示意图.该电池工作时,有关说法正确的是 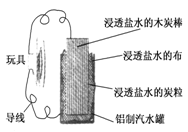
| A.炭棒应与玩具电机的负极相连 |
| B.炭粒和炭棒上发生的反应为:O2+4e-=2O2- |
| C.铝罐将逐渐被腐蚀 |
| D.该电池工作一段时间后炭棒和炭粒的质量会减轻 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
现有A、B、C、D四种金属片,①把A、B用导线连接后同时浸入稀硫酸中,B上有气泡产生;②把C、D用导线连接后同时浸入稀硫酸中,C上发生还原反应;③把B、D用导线连接后同时浸入稀硫酸中,电子流动方向为:B→导线→D,则下列关于金属活动由强到弱顺序正确的是
A.B>A>C>D B.A>B>D>C C.A>B>C>D D.B>A>D>C
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
原电池的电极名称不仅与电极的性质有关,也与电解质溶液有关,下列说法中不正确的是
| A.有Al、Cu、稀H2SO4组成原电池,其负极反应式为:Al-3 e-=Al3+ |
| B.Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3 e-=Al3+ |
| C.由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Fe-2e-═Fe2+, |
| D.由Al、Cu、浓硝酸组成原电池,其负极反应式为:Cu-2e-=Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分)
(1)若用食用油炒咸菜的铁锅如果没有洗净,不久会出现红褐色锈斑。则铁锅的锈蚀属于 腐蚀(填“析氢”或“吸氧”);该腐蚀正极的电极反应式为 ;此反应每转移2mol电子消耗的O2在标准状况下的体积为 L。
(2)某同学用碳棒、铜棒和稀硫酸为原材料,实现了在通常条件下不能发生的反应:Cu+H2SO4(稀)=CuSO4+H2↑。请在下边方框中画出能够实验这一反应的装置图(作必要的标注);某同学做该实验时,看到
碳棒上有气泡产生,铜棒上气泡更多且没有被腐蚀,其原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病,KI、KIO3曾先后用于加碘盐中。
(1)工业上可以通过铁屑法生产KI,其工艺流程如下:
①反应I生成铁与碘的化合物,若该化合物中铁元素与碘元素的质量比为21:127,则加入足量碳酸钾时,反应Ⅱ的化学方程式为 。
②操作A包括 ;用冰水洗涤的目的是 。
(2)KIO3可以通过H2O2氧化I2先制得HIO3,然后再用KOH中和的方法进行生产。
①烹饪时,含KIO3的食盐常在出锅前加入,其原因是 。
②若制得1284 kg KIO3固体,理论上至少需消耗质量分数为30%的双氧水 kg。
③KIO3还可通过下图所示原理进行制备。电解时总反应的离子方程式为 。若忽略溶液体积的变化,则电解结束后阴极区的pH与电解前相比 (选填“增大”、“减小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com