
碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病,KI、KIO3曾先后用于加碘盐中。
(1)工业上可以通过铁屑法生产KI,其工艺流程如下:
①反应I生成铁与碘的化合物,若该化合物中铁元素与碘元素的质量比为21:127,则加入足量碳酸钾时,反应Ⅱ的化学方程式为 。
②操作A包括 ;用冰水洗涤的目的是 。
(2)KIO3可以通过H2O2氧化I2先制得HIO3,然后再用KOH中和的方法进行生产。
①烹饪时,含KIO3的食盐常在出锅前加入,其原因是 。
②若制得1284 kg KIO3固体,理论上至少需消耗质量分数为30%的双氧水 kg。
③KIO3还可通过下图所示原理进行制备。电解时总反应的离子方程式为 。若忽略溶液体积的变化,则电解结束后阴极区的pH与电解前相比 (选填“增大”、“减小”或“不变”)。
(1)① Fe3I8 + 4K2CO3 = Fe3O4 + 8KI + 4CO2↑ (2分)
②加热浓缩、冷却结晶、过滤 (2分)
洗涤除去表面可溶性杂质,同时减少KI的溶解损失 (2分)
(2)①在较高温度下KIO3易分解(2分) ②1700 (2分)
③I一+ 3H2O通电IO3- + 3H2↑ (2分) 不变(2分)
解析试题分析:(1)①反应I生成铁与碘的化合物,铁元素与碘元素的质量比为21:127,即物质的量比是 =3:8,故反应方程式是Fe3I8 + 4K2CO3 = Fe3O4 + 8KI + 4CO2↑。
=3:8,故反应方程式是Fe3I8 + 4K2CO3 = Fe3O4 + 8KI + 4CO2↑。
②用冰水洗涤的目的是洗涤除去表面可溶性杂质,同时减少KI的溶解损失;
(2)①烹饪时,含KIO3的食盐常在出锅前加入,其原因是在较高温度下KIO3易分解;
②因为H2O2氧化I2先制得HIO3:5H2O2+I2==2HIO3+4H2O,即5H2O2~2IO3-,1284 kg KIO3固体为6k mol,故m(H2O2)= 5/2×6kmol×34g·mol-1/30%=1700kg。
③虽然阴极区有大量氢氧根离子生成,但阳极区反应消耗氢氧根离子,氢氧根离子通过阴离子交换膜到阳极区反应,总反应中没有酸或碱生成以及消耗。故而阴极区反应前后pH没有变化。当然,如果题目没有“忽略溶液体积变化“的说明,情况就不同了,随着电解的进行,总反应耗水,阴极区pH会增大。
考点:官能团为酯键的芳香化合物的性质。


科目:高中化学 来源: 题型:单选题
硝酸汞和碘化钾溶液混合后会生成红色的碘化汞沉淀,为了探究硝酸汞和碘化钾溶液之间能否发生氧化还原反应,研究人员设计了如图的实验装置,结果电流计指针发生了偏转,下列分析正确的是( )
| A.如图装置的电流方向是从C1到C2 |
| B.C1是负极,发生的反应是2I-=I2+2e- |
| C.K+离子向C1电极流动 |
| D.装置发生的总反应是Hg2++2I-=HgI2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(8分)试用 ══
══ ↑的反应设计原电池。
↑的反应设计原电池。
(1)原电池中使用的电解质溶液是 ;
(2)写出电极反应式:
负极: ,
正极: ;
(3)在方框中画出此原电池的图,并标出电极材料的名称。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(8分)被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.下图为氢氧燃料电池的结构示意图,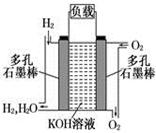
电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:
(1) 写出氢氧燃料电池工作时正极电极反应方程式: ___________ 。
(2)如果该氢氧燃料电池每转移0.1mol电子,消耗标准状况下___________L氧气。
(3) 若将此燃料电池改进为直接以甲烷和氧气为原料进行工作时,负极反应式为___________________。 电池总离子反应方程式为_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(15分)(1)铅是碳的同族元素,比碳多4个电子层。铅在元素周期表的位置为第 周期.第 族;PbO2的酸性比CO2的酸性 (填“强”或“弱”)。
(2)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为 。
(3)PbO2可由PbO与次氯酸钠溶液反应制得,反应的离子方程式为 ;PbO2也可以通过石墨为电极,Pb(NO3)2和Cu(NO3)2的混合溶液为电解液电解制取。阳极发生反应的电极反应式为 ,阴极上观察到的现象是 ;若电解液中不加入Cu(NO3)2,阴极发生的电极反应式为 ,这样做的主要缺点是 。
(4)PbO2在加热过程发生分解的失重曲线如下图所示,已知失重曲线上的a点为样品失重的4.0%(即样品起始质量—a点固体质量/样品起始质量×100%)的残留固体。若a点固体组成表示为PbOx或mPbO2 ·nPbO,列式计算x值和m:n值 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(11分)甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题:
(1)若两池中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲池中的________棒,乙池中的________棒。
②乙池中阳极的电极反应式是_______________________________________________ _。
(2)若两池中均为饱和NaCl溶液:
①写出乙池中总反应的离子方程式__________________________________________。
②甲池中碳极上电极反应式是____________________,乙池中碳极上电极反应属于____________(填“氧化反应”或“还原反应”)。
③若乙池转移0.02 mol e-后停止实验,该池中溶液体积是200 mL,则溶液混匀后的pH=________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
锂的化合物用途广泛。Li3N是非常有前途的储氢材料;LiFePO4、Li2FeSiO4等可以作为电池的正级材料。回答下列问题:
(1)将锂在纯氮气中燃烧可制得Li3N,其反应的化学方程为 。
(2)氮化锂在氢气中加热时可得到氨基锂(LiNH2),其反应的化学方程式为:
Li3N+2H2 LiNH2+2LiH,氧化产物为 (填化学式)。在270℃时,该反应可逆向发生放出H2,因而氮化锂可作为储氢材料,储存氢气最多可达Li3N质量的 %(精确到0.1)。
LiNH2+2LiH,氧化产物为 (填化学式)。在270℃时,该反应可逆向发生放出H2,因而氮化锂可作为储氢材料,储存氢气最多可达Li3N质量的 %(精确到0.1)。
(3)将Li2CO3、FeC2O4·2H2O和SiO2粉末均匀混合,在800℃的氩气中烧结6小时制得Li2FeSiO4,写出反应的化学方程式 ,制备Li2FeSiO4的过程必须在惰性气体氛围中进行,其原因是 。
(4)将一定浓度磷酸二氢铵、氯化锂混合溶液作为电解液,以铁棒为阳极,石墨为阴极,电解析出LiFePO4沉淀,阳极的电极反应式为 。
(5)磷酸亚铁锂电池充放电过程中,发生LiFePO4与Li FePO4之间的转化,电池放电时负极发生的反应为LiXC6-Xe—
FePO4之间的转化,电池放电时负极发生的反应为LiXC6-Xe— XLi++6C,写出电池放电时的电极反应的化学方程式 。
XLi++6C,写出电池放电时的电极反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某实验小组的同学采用如图所示装置来进行有关化学实验,请填充下列空格。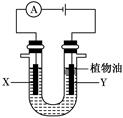
(1)若U形管中盛有硫酸钠溶液,X、Y电极分别为石墨和铁棒,电解过程中出现的现象是 。
U形管中加入的少量植物油作用是 。
(2)电解一段时间后,某同学将电源反接,此时出现的现象是 。有关的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氯碱工业是最基本的化学工业之一,离子膜电解法为目前普遍使用的生产方法,其生产流程如下图所示:
(1)该流程中可以循环的物质是 。
(2)电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有Ca2+、Mg2+、SO42-等无机杂质,所以在进入电解槽前需要进行两次精制,写出一次精制中发生的离子方程式 ,若食盐水不经过二次精制就直接进入离子膜电解槽会产生什么后果 。
(3)右图是工业上电解饱和食盐水的离子交换膜电解槽示意图(阳极用金属钛网制成,阴极由碳钢网制成)。则B处产生的气体是 ,E电极的名称是 。电解总反应的离子方程式为 。
(4)从阳极槽出来的淡盐水中,往往含有少量的溶解氯,需要加入8%~9%的亚硫酸钠溶液将其彻底除去,该反应的化学方程式为 。
(5)已知在电解槽中,每小时通过1安培的直流电可以产生1.492g的烧碱,某工厂用300个电解槽串联生产8小时,制得32%的烧碱溶液(密度为1.342吨/m3)113m3,电解槽的电流强度1.45 ×104A,该电解槽的电解效率为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com