
(8分)试用 ══
══ ↑的反应设计原电池。
↑的反应设计原电池。
(1)原电池中使用的电解质溶液是 ;
(2)写出电极反应式:
负极: ,
正极: ;
(3)在方框中画出此原电池的图,并标出电极材料的名称。
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:填空题
(10分)
(1)若用食用油炒咸菜的铁锅如果没有洗净,不久会出现红褐色锈斑。则铁锅的锈蚀属于 腐蚀(填“析氢”或“吸氧”);该腐蚀正极的电极反应式为 ;此反应每转移2mol电子消耗的O2在标准状况下的体积为 L。
(2)某同学用碳棒、铜棒和稀硫酸为原材料,实现了在通常条件下不能发生的反应:Cu+H2SO4(稀)=CuSO4+H2↑。请在下边方框中画出能够实验这一反应的装置图(作必要的标注);某同学做该实验时,看到
碳棒上有气泡产生,铜棒上气泡更多且没有被腐蚀,其原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(16分) 以食盐为原料进行生产并综合利用的某些过程如下图所示。
除去粗盐中的 、
、 和
和 离子,加入下列沉淀剂的顺序是(填序号)_____________ 。
离子,加入下列沉淀剂的顺序是(填序号)_____________ 。
A.  B.
B. 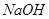 C.
C. 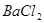
(2)将滤液的 调至酸性除去的离子有___________________。
调至酸性除去的离子有___________________。
(3)人们习惯上把电解饱和食盐水的工业叫做氯碱工业。下图表示电解饱和NaCl溶液的装置,X、Y是石墨棒。实验开始时,在两边同时各滴入几滴酚酞溶液,请回答以下问题:X极上的电极反应式是_____,在X极附近观察到的现象是________________;Y电极上的电极反应式是______,检验该电极反应产物的方法是_______________ 。电解 溶液的离子方程式是_____________________。
溶液的离子方程式是_____________________。
(4)若向分离出 晶体后的母液中加入过量生石灰,则可获得一种可以循环使用的气体,其化学式是 _____________________ 。
晶体后的母液中加入过量生石灰,则可获得一种可以循环使用的气体,其化学式是 _____________________ 。
(5)某同学设计一个燃料电池(如下图所示),目的是探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。
根据要求回答相关问题:
①通入氢气的电极为 (填“正极”或“负极”),负极的电极反应式为 。
②石墨电极为 (填“阳极”或“阴极”),反应一段时间后,在乙装置中滴入酚酞溶液,_ 区(填“铁极”或“石墨极”)的溶液先变红。
③如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将 ,填“增大”“减 小”或“不变”)。精铜电极上的电极反应式为______________。
④若在标准状况下,有224m L氧气参加反应,则乙装置中铁电极上生成的气体在标况下体积为 ;丙装置中阴极析出铜的质量为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上生产氯气,常用电解槽中电解饱和食盐水,为了避免电解产物之间发生反应,常用阳离子交换膜将电解槽隔成两部分。下图(左图)为电解槽的示意图。
⑴这种阳离子交换膜,只允许溶液中的 通过。(填下列微粒的编号)
① ②
② ③
③ ④
④ ⑤
⑤ ⑥
⑥
⑵写出在电解过程中阳极发生的电极方程式: 。
⑶已知某电解槽每小时加入10%的氢氧化钠溶液10kg,每小时能收集到标况下的氢气896L,而且两边的水不能自由流通。则理论上计算,电解后流出的氢氧化钠溶液的质量分数为 。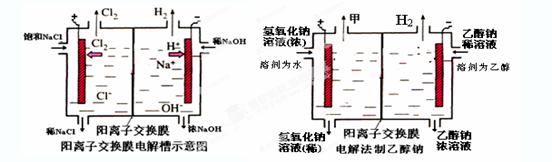
⑷某化学课外兴趣小组设计了用电解法制取乙醇钠的工业方法,所用的电解槽如上右图所示,设计要求:①所用的交换膜不能让分子自由通过;②电解过程中消耗的原料是氢氧化钠和乙醇。回答下列问题:
写出在电解过程中阳极发生的电极方程式 。
②最后从乙醇钠的乙醇溶液中分离得到纯净乙醇钠固体的方法是: 。
(5)如图所示的是一个燃料电池的示意图,当此燃料电池工作时,
①如果a极通入H2,b极通入O2,NaOH溶液作电解质溶液,则负极发生的电极方程式:
②如果a极通入CH4,b极通入O2,NaOH作电解质溶液,则负极发生的电极方程式:
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(8分)将质量相等的铁片和铜片用导线相连浸入500mL硫酸铜溶液中构成如图1的装置:
(以下均假设反应过程中溶液体积不变)。
⑴铁片上的电极反应式为 。
⑵铜片周围溶液会出现 的现象。
⑶若2 min后测得铁片和铜片之间的质量差为1.2g,计算:
①导线中流过的电子的物质的量为 mo1;
②该段时间内用硫酸铜表示的平均反应速率为
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病,KI、KIO3曾先后用于加碘盐中。
(1)工业上可以通过铁屑法生产KI,其工艺流程如下:
①反应I生成铁与碘的化合物,若该化合物中铁元素与碘元素的质量比为21:127,则加入足量碳酸钾时,反应Ⅱ的化学方程式为 。
②操作A包括 ;用冰水洗涤的目的是 。
(2)KIO3可以通过H2O2氧化I2先制得HIO3,然后再用KOH中和的方法进行生产。
①烹饪时,含KIO3的食盐常在出锅前加入,其原因是 。
②若制得1284 kg KIO3固体,理论上至少需消耗质量分数为30%的双氧水 kg。
③KIO3还可通过下图所示原理进行制备。电解时总反应的离子方程式为 。若忽略溶液体积的变化,则电解结束后阴极区的pH与电解前相比 (选填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
电化学原理在工业生产中有着重要的作用,请利用所学知识回答有关问题。
(1)用电解的方法将硫化钠溶液氧化为多硫化物的研究具有重要的实际意义,将硫化物转变为多硫化物是电解法处理硫化氢废气的一个重要内容。如是电解产生多硫化物的实验装置:
①已知阳极的反应为(x+1)S2-=Sx+S2-+2xe-,则阴极的电极反应式是____________________________
当反应转移x mol电子时,产生的气体体积为____________(标准状况下)。
②将Na2S·9H2O溶于水中配制硫化物溶液时,通常是在氮气气氛下溶解。其原因是(用离子反应方程式表示):___________________________。
(2)MnO2是一种重要的无机功能材料,制备MnO2的方法之一是以石墨为电极,电解酸化的MnSO4溶液,阳极的电极反应式为______________________。现以铅蓄电池为电源电解酸化的MnSO4溶液,如图所示,铅蓄电池的总反应方程式为_______________________,
当蓄电池中有4 mol H+被消耗时,则电路中通过的电子的物质的量为________,MnO2的理论产量为________g。
(3)用图电解装置可制得具有净水作用的 。实验过程中,两极均有气体产生,Y极区溶液逐渐生成
。实验过程中,两极均有气体产生,Y极区溶液逐渐生成

①电解过程中,X极区溶液的pH________(填“增大”“减小”或“不变”)。
②电解过程中,Y极发生的电极反应为Fe-6e-+8OH-= +4H2O和______________________________,若在X极收集到672 mL气体,在Y极收集到168 mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少________g。
+4H2O和______________________________,若在X极收集到672 mL气体,在Y极收集到168 mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少________g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com