
(16分) 以食盐为原料进行生产并综合利用的某些过程如下图所示。
除去粗盐中的 、
、 和
和 离子,加入下列沉淀剂的顺序是(填序号)_____________ 。
离子,加入下列沉淀剂的顺序是(填序号)_____________ 。
A.  B.
B. 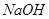 C.
C. 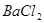
(2)将滤液的 调至酸性除去的离子有___________________。
调至酸性除去的离子有___________________。
(3)人们习惯上把电解饱和食盐水的工业叫做氯碱工业。下图表示电解饱和NaCl溶液的装置,X、Y是石墨棒。实验开始时,在两边同时各滴入几滴酚酞溶液,请回答以下问题:X极上的电极反应式是_____,在X极附近观察到的现象是________________;Y电极上的电极反应式是______,检验该电极反应产物的方法是_______________ 。电解 溶液的离子方程式是_____________________。
溶液的离子方程式是_____________________。
(4)若向分离出 晶体后的母液中加入过量生石灰,则可获得一种可以循环使用的气体,其化学式是 _____________________ 。
晶体后的母液中加入过量生石灰,则可获得一种可以循环使用的气体,其化学式是 _____________________ 。
(5)某同学设计一个燃料电池(如下图所示),目的是探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。
根据要求回答相关问题:
①通入氢气的电极为 (填“正极”或“负极”),负极的电极反应式为 。
②石墨电极为 (填“阳极”或“阴极”),反应一段时间后,在乙装置中滴入酚酞溶液,_ 区(填“铁极”或“石墨极”)的溶液先变红。
③如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将 ,填“增大”“减 小”或“不变”)。精铜电极上的电极反应式为______________。
④若在标准状况下,有224m L氧气参加反应,则乙装置中铁电极上生成的气体在标况下体积为 ;丙装置中阴极析出铜的质量为 。
(1)C、A、B 或者C、B、A或者B、C、A;
(2)CO32-和OH-
(3)2H++2e-=H2↑;有无色气泡产生,溶液变红 ; 2Cl—--2e-=Cl2↑;
将湿润的KI淀粉试纸放在气体出口,若观察到试纸变蓝,证明有Cl2产生;
2Cl—+2H2O Cl2↑+ H2↑+2OH-
Cl2↑+ H2↑+2OH-
(4)NH3
(5)①负极、 H2-2e-+2OH-==2H2O ② 阳极、铁极
③减小 Cu2+ + 2e--== Cu ④0.448L、 1.28 g
解析试题分析:(1)除去Ca2+用CO32-;除去Mg2+用OH-,除去SO42-用Ba2+。为了将杂质除尽,除杂试剂就要过量。还要按照一定的顺序来除,不然就会使除杂的步骤增多,使实验麻烦,分析应该使SO42-离子在Ca2+离子之前除去,这样加入的CO32-能够将Ca2+和引入来的Ba2+一并除去,其余的杂质无先后关系,因此加入下列沉淀剂的顺序是C、A、B 或者C、B、A或者B、C、A;(2)将滤液的pH调至酸性除去的离子有CO32-和OH-;(3)根据与电源的连接方式可知:X是阴极,Y是阳极;在阴极由于水电离产生H+放电能力强,所以发生反应2H++2e-=H2↑;由于H+不断放电产生氢气,所以破坏了附近的水的电离平衡,在附近溶液中OH-离子的浓度大于H+的浓度,因此溶液显碱性,使酚酞试液变为红色;在阳极Y电极上由于Cl-放电能力比OH-的强,所以该电极反应式是2Cl—--2e-=Cl2↑;检验该电极反应产物的方法是将湿润的KI淀粉试纸放在气体出口,若观察到试纸变蓝,证明有Cl2产生;电解NaCl溶液的离子方程式是2Cl—+2H2O Cl2↑+ H2↑+2OH-;(4)分离出NaHCO3晶体后的母液中含有NH4Cl,若向其中加入过量生石灰,则可获得一种可以循环使用的气体,其化学式是NH3 ;(5)①通入氢气的电极为负极,由于电解质溶液是碱性的,所以在该电极反应式为H2-2e-+2OH-==2H2O;②由于石墨电极与电源的正极连接,所以石墨电极为阳极,反应一段时间后,在乙装置中滴入酚酞溶液,溶液中的H+在阴极(Fe电极)放电,平衡了附近的水的电离平衡,该区域的溶液显碱性,因此铁极的溶液先变红。③如果粗铜中含有锌、银等杂质,因为粗铜中有活动性比Cu强的金属失去电子,而得到电子的只有Cu2+,所以丙装置中反应一段时间,硫酸铜溶液浓度会减小;精铜电极上的电极反应式为Cu2+ + 2e--==Cu ;④若在标准状况下,有224m L氧气参加反应,n(O2)=0.224L÷22.4L/mol=0.01mol,n(e-)=0.04mol由于在整个闭合回路中电子转移数目相等,则乙装置中铁电极上生成的氢气的物质的量是0.02mol,气体在标况下体积为0.02mol×22.4L/mol=0.448L;丙装置中阴极析出铜的质量为0.02mol×64g/mol=1.28g。
Cl2↑+ H2↑+2OH-;(4)分离出NaHCO3晶体后的母液中含有NH4Cl,若向其中加入过量生石灰,则可获得一种可以循环使用的气体,其化学式是NH3 ;(5)①通入氢气的电极为负极,由于电解质溶液是碱性的,所以在该电极反应式为H2-2e-+2OH-==2H2O;②由于石墨电极与电源的正极连接,所以石墨电极为阳极,反应一段时间后,在乙装置中滴入酚酞溶液,溶液中的H+在阴极(Fe电极)放电,平衡了附近的水的电离平衡,该区域的溶液显碱性,因此铁极的溶液先变红。③如果粗铜中含有锌、银等杂质,因为粗铜中有活动性比Cu强的金属失去电子,而得到电子的只有Cu2+,所以丙装置中反应一段时间,硫酸铜溶液浓度会减小;精铜电极上的电极反应式为Cu2+ + 2e--==Cu ;④若在标准状况下,有224m L氧气参加反应,n(O2)=0.224L÷22.4L/mol=0.01mol,n(e-)=0.04mol由于在整个闭合回路中电子转移数目相等,则乙装置中铁电极上生成的氢气的物质的量是0.02mol,气体在标况下体积为0.02mol×22.4L/mol=0.448L;丙装置中阴极析出铜的质量为0.02mol×64g/mol=1.28g。
考点:考查以食盐为原料进行生产并综合利用的知识。主要包括粗盐的提纯、原电池、电解池、金属的精炼及有关计算的知识。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:单选题
已知铅蓄电池放电过程可以表示为PbO2 + 2 H2SO4 + Pb="2" PbSO4 + 2H2O下列关于铅蓄电池的说法正确的是
| A.Pb为正极,PbO2为负极 |
| B.正极电极反应式为PbO2 + SO4 2- + 2H+ =PbSO4 + H2O |
| C.硫酸溶液中,H+移向负极 |
| D.放电一段时间后,SO4 2-浓度减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知外电路中,电子由铜流向a极。有关下图所示的装置分析合理一项是( )
| A.该装置中Cu极为正极 |
| B.当铜极的质量变化为12.8 g时,a极上消耗的O2在标准状况下的体积为2.24 L |
C.b极反应的电极反应式为:H2一2 = 2H+ = 2H+ |
| D.一段时间后锌片质量减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(6分)现有如下两个反应:
A.NaOH + HCl =" NaCl" + H2O B.2FeCl3+Cu =2FeCl2+CuCl2
(1)根据两反应本质, 判断能设计成原电池的是:_______,(填序号 )。
(2)不能的, 说明其原因_______________________________________________;(2分)
(3)如果可以, 写出负极材料及其电极反应式, 电解质溶液名称:
负极材料________,电极反应式_______________,电解质溶液名称____________,
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上电解制碱的技术是用阳离子交换膜法,主要原料是饱和食盐水。下图为阳离子交换膜法电解原理示意图:
请回答下列问题:
(1)A极为电解槽的________极,B极的材料工业上常采用的是生活中常见的金属,但有大量损耗,其主要原因是 。(填“吸氧腐蚀”或“析氢腐蚀”)
(2)电解槽中部的阳离子交换膜把电解槽隔成了阴极室和阳极室,这种阳离子交换膜,只允许溶液中的__________通过(填写下列微粒的编号)。
①H2,②Cl2,③H+,④Cl-,⑤Na+,⑥OH-。
(3)若上述电解过程中用阴离子交换膜代替阳离子交换膜(已知:3Cl2 +6OH-==5Cl-+ClO3-+3H2O),下列说法正确的组合是 。
| A.电解结束时,右侧溶液中含有ClO3— |
B.电解槽内发生反应的总化学方程式为:NaCl + 3H2O  NaClO3 + 3H2↑ NaClO3 + 3H2↑ |
| C.用阴离子交换膜后,电解槽内两个电极发生的电极反应与原来一样 |
| D.用阴离子交换膜后,阳离子的定向移动方向与原来相反 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(8分)试用 ══
══ ↑的反应设计原电池。
↑的反应设计原电池。
(1)原电池中使用的电解质溶液是 ;
(2)写出电极反应式:
负极: ,
正极: ;
(3)在方框中画出此原电池的图,并标出电极材料的名称。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
如图为以惰性电极进行电解的串联电解装置图
(1)写出A、B、C、D各电极上的电极方程式。
A ;
B ;
C ’
D 。
(2)在A、B、C、D各电极上析出生成物的物质的量比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(15分)(1)铅是碳的同族元素,比碳多4个电子层。铅在元素周期表的位置为第 周期.第 族;PbO2的酸性比CO2的酸性 (填“强”或“弱”)。
(2)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为 。
(3)PbO2可由PbO与次氯酸钠溶液反应制得,反应的离子方程式为 ;PbO2也可以通过石墨为电极,Pb(NO3)2和Cu(NO3)2的混合溶液为电解液电解制取。阳极发生反应的电极反应式为 ,阴极上观察到的现象是 ;若电解液中不加入Cu(NO3)2,阴极发生的电极反应式为 ,这样做的主要缺点是 。
(4)PbO2在加热过程发生分解的失重曲线如下图所示,已知失重曲线上的a点为样品失重的4.0%(即样品起始质量—a点固体质量/样品起始质量×100%)的残留固体。若a点固体组成表示为PbOx或mPbO2 ·nPbO,列式计算x值和m:n值 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
根据右图回答以下问题:
(A、B均为碳棒,两池中溶液均足量)
(1)甲装置是 池,乙装置是 池且Fe极为 极,A极为 极
(2)A极的电极反应
(3)若甲池中Fe溶解0.3 mol,则乙池中产生气体的体积(标准状况)为 L,
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com