
【题目】图为氯碱工业的简易装置示意图,其中两电极均为惰性电极,下列说法正确的是

A.粗盐水中含有的少量Ca2+和Mg2+可用NaOH除去
B.阳离子交换膜允许Na+通过,而阻挡了Cl2进入B室
C.a处得到的是浓NaOH溶液
D.饱和食盐水从B室底部加入
【答案】B
【解析】
氯碱工业的原理是2NaCl+2H2O ![]() 2NaOH+H2
2NaOH+H2![]() +Cl2
+Cl2![]() 。A室连接电源的正极,失去电子,发生氧化反应,2Cl--2e-= Cl2
。A室连接电源的正极,失去电子,发生氧化反应,2Cl--2e-= Cl2![]() ,B室连接电源的负极,得到电子,发生还原反应,2H2O+2e-=2OH-+ H2
,B室连接电源的负极,得到电子,发生还原反应,2H2O+2e-=2OH-+ H2![]() ,Na+由A室移动到B室。
,Na+由A室移动到B室。
A.Ca(OH)2微溶,少量Ca2+用NaOH除去效果不好,可用Na2CO3除去,A错误;
B.由上述分析可知,Na+经阳离子交换膜由A室移动到B室,不可用阴离子交换膜,否则OH-会从B室移动到A室,与Cl2反应,B正确;
C.由上面分析可知,A室发生反应为2Cl--2e-= Cl2![]() ,并且Na+由A室移动到B室,所以A室损失了Cl-和Na+,由浓NaCl溶液变化为稀NaCl溶液,所以a处得到的是稀NaCl溶液,C错误;
,并且Na+由A室移动到B室,所以A室损失了Cl-和Na+,由浓NaCl溶液变化为稀NaCl溶液,所以a处得到的是稀NaCl溶液,C错误;
D.由上面分析可知,A室发生反应为2Cl--2e-= Cl2![]() ,并且Na+由A室移动到B室,所以A室损失了Cl-和Na+,由浓NaCl溶液变化为稀NaCl溶液,所以需要补充浓NaCl溶液,所以饱和食盐水从A室底部加入,D错误;
,并且Na+由A室移动到B室,所以A室损失了Cl-和Na+,由浓NaCl溶液变化为稀NaCl溶液,所以需要补充浓NaCl溶液,所以饱和食盐水从A室底部加入,D错误;
答案选B。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】已知X、Y、Z三种元素组成的化合物是离子晶体,其晶胞如图所示,X、Y、Z分别处于立方体的顶点、棱边的中点、立方体的体心。则下面关于该化合物的说法正确的是( )
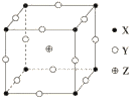
A. 该晶体的化学式为ZXY3
B. 该晶体的熔点一定比金属晶体熔点高
C. 每个X周围距离最近的Y有8个
D. 每个Z周围距离最近的X有16个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极 a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2Sx(2≤x≤8)。下列说法错误的是( )

A. 电池工作时,正极可发生反应:2Li2S6+2Li++2e-=3Li2S4
B. 电池工作时,外电路中流过 0.02 mol 电子,负极材料减重 0.14 g
C. 石墨烯的作用主要是提高电极a的导电性
D. 电池充电时间越长,电池中Li2S2的量越多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱。25℃时,有关物质的电离平衡常数如下表所示。根据该表,回答下列问题:
化学式 | HF | CH3COOH | H2SO3 | H2CO3 | H2S |
电离平衡 常数(Ka) | 4.0×10-4 | 1.8×10-5 | K1=1.54×10-2 K2=1.02×10-7 | K1=4.4×10-7 K2=4.7×10-11 | K1=9.1×10-8 K2=1.1×10-12 |
(1)同浓度的F-、CO32-、CH3COO-、HS-结合H+的能力最强的为__________
(2)溶液中不可能大量共存的离子组是__________
a.HS-、SO32- b.HF、CH3COO- c.HS-、HCO3- d. HSO3-、HCO3-
(3)Na2CO3溶液通入过量H2S的离子方程式是:_____。
(4)OH-浓度相同的等体积的两份溶液HCl(A)和 CH3COOH(E),分别与锌粉反应,若最后仅有一份溶液中存在锌,放出氢气的质量相同,则下列说法正确的是_______(填写序号)。
①反应所需要的时间E>A ②开始反应时的速率A>E
③参加反应的锌的物质的量A=E ④反应过程的平均速率E>A
⑤A溶液里有锌剩余 ⑥E溶液里有锌剩余
(5)向 0.l molL-1 CH3COOH溶液中滴加 NaOH 溶液至c(CH3COOH) : c(CH3COO-) =2 : 36,此时溶液pH = __________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CO2(g) + 3H2(g)![]() CH3OH(g) + H2O(g) ΔH =-49.0 kJmol-1。一定条件下,向体积为1 L的密闭容器中充入1 mol CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如右图所示。下列叙述中,正确的是 ( )
CH3OH(g) + H2O(g) ΔH =-49.0 kJmol-1。一定条件下,向体积为1 L的密闭容器中充入1 mol CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如右图所示。下列叙述中,正确的是 ( )
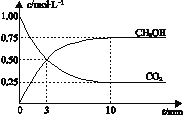
A. 升高温度能使![]() 增大
增大
B. 反应达到平衡状态时,CO2的平衡转化率为75%
C. 3 min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率
D. 从反应开始到平衡,H2的平均反应速率υ(H2)=0.075 molL-1min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不锈钢是由铁、铬(Cr)、镍(Ni)、碳、硅及众多不同元素组成的合金。完成下列填空:
(1)写出碳原子最外层电子的轨道表示式______________,其最外层有____种不同运动状态的电子。
(2)硅烷(SiH4)可用于制备高纯硅,已知硅烷的分解温度远低于甲烷,从原子结构角度解释其原因:_____________________________________________________。
(3)下面是工业上冶炼Cr时涉及到的反应:
CrO42-+ S+ H2O→ Cr(OH)3↓+ S2O32-+
①请将方程式补充完整并配平____________________。
②上述反应中,若转移了3mol电子,得到的还原产物是__________mol。
③Cr(OH)3和Al(OH)3类似,也是两性氢氧化物,写出Cr(OH)3的电离方程式________。
(4)镍粉在CO中低温加热,生成无色挥发性液态Ni(CO)4,呈四面体构型。Ni(CO)4是________________晶体,Ni(CO)4易溶于下列_______(填序号)。
a.水 b.四氯化碳 c.苯 d.硫酸镍溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在105℃时1 L该混合烃与9 L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10 L.下列各组混合烃中一定不符合条件的是
A. CH4、C2H4B. C2H2、C3H6C. C3H4、C2H4D. CH4、C3H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某可逆反应:mA(g) + nB(g)![]() pC(g) H= Q kJ·mol-1,在密闭容器中进行,右图表示在不同时间t、温度T和压强P与生成物C的百分含量的关系曲线,下列判断正确的是
pC(g) H= Q kJ·mol-1,在密闭容器中进行,右图表示在不同时间t、温度T和压强P与生成物C的百分含量的关系曲线,下列判断正确的是
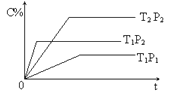
A. T1<T2 P1>P2 m+n<P Q<0B. T1>T2 P1<P2 m+n>P Q>0
C. T1<T2 P1<P2 m+n<P Q>0D. T1>T2 P1<P2 m+n>P Q<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由Zn、Cu、Al、Fe四种金属中的两种组成的混合物41.5g,与足量的盐酸反应产生的氢气在标况下为22.4升,则混合物中一定含有的金属是 ( )
A.ZnB.FeC.AlD.Cu
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com