
【题目】已知某可逆反应:mA(g) + nB(g)![]() pC(g) H= Q kJ·mol-1,在密闭容器中进行,右图表示在不同时间t、温度T和压强P与生成物C的百分含量的关系曲线,下列判断正确的是
pC(g) H= Q kJ·mol-1,在密闭容器中进行,右图表示在不同时间t、温度T和压强P与生成物C的百分含量的关系曲线,下列判断正确的是
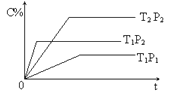
A. T1<T2 P1>P2 m+n<P Q<0B. T1>T2 P1<P2 m+n>P Q>0
C. T1<T2 P1<P2 m+n<P Q>0D. T1>T2 P1<P2 m+n>P Q<0
科目:高中化学 来源: 题型:
【题目】25℃时,醋酸溶液中存在电离平衡:CH3COOH![]() CH3COO-+ H+,下列说法正确的是
CH3COO-+ H+,下列说法正确的是
A.向体系中加入少量CH3COONa固体,平衡向左移动,c(CH3COO-)下降
B.向体系中加水稀释,平衡向右移动,溶液中所有离子的浓度都减小
C.加入少量NaOH固体(忽略溶解热效应),平衡向右移动,水的电离程度也随之增大
D.升高体系温度(忽略醋酸挥发),溶液中H+数目增多,平衡一定向左移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图为氯碱工业的简易装置示意图,其中两电极均为惰性电极,下列说法正确的是

A.粗盐水中含有的少量Ca2+和Mg2+可用NaOH除去
B.阳离子交换膜允许Na+通过,而阻挡了Cl2进入B室
C.a处得到的是浓NaOH溶液
D.饱和食盐水从B室底部加入
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在生产和日常生活中有着重要的应用,下表中用途与其性质或原理对应关系不正确的是 ( )
选项 | 现象或事实 | 解释 |
A | Na2O2常用于潜水艇或呼吸面具的供氧剂 | Na2O2与H2O、CO2反应产生O2 |
B | 常用铝箔做包装材料 | 金属铝有好的延展性 |
C | FeCl3溶液可用于刻制印刷铜电路板 | FeCl3可与Cu发生反应 |
D | 烧菜用过的铁锅,经放置常出现红棕色斑迹 | 烧菜时铁锅被染色 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从古至今,铁及其化合物在人类的生产生活中都起了巨大的作用。
(1)古代中国四大发明之一的指南针是由天然磁石制成的,其主要成分是_________________。
A.Fe B.FeO C.Fe3O4 D.Fe2O3
(2)在现代化工生产中,常利用FeCl3腐蚀铜的原理制作印刷线路板,写出该原理的化学方程式_________________________________。
(3)实验室用绿矾FeSO4·xH2O配制FeSO4溶液时为了防止FeSO4溶液变质,经常向其中加入铁粉,其原因是_____________________ (用离子方程式表示)。
(4)某同学甲取2 mL FeSO4溶液,加入1滴KSCN溶液,再加入几滴氯水,溶液变红,说明Cl2可将Fe2+氧化。绿矾溶液与氯水反应的离子方程式为_______。
(5)同学乙认为甲同学的实验不够严谨,该同学在2 mL FeSO4 溶液中先加入0.5 mL煤油,再于液面下依次加入1滴KSCN溶液和几滴氯水,溶液变红,煤油的作用是_____________。
(6)为测定某绿矾FeSO4·xH2O中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1 g;将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g;按下图连接好装置进行实验:

①仪器B的名称是____________。
②将下列实验操作步骤正确排序__________(填标号);重复上述操作步骤,直至A恒重,记为m3 g。
a.点燃酒精灯,加热
b.熄灭酒精灯
c.关闭K1和K2
d.打开K1和K2,缓缓通入N2
e.称量A
f.冷却至室温
③根据实验记录,计算绿矾FeSO4·xH2O化学式中结晶水数目x=_______________________(列式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,正确的是 ( )
A.NH4HCO3溶液中加入过量的NaOH溶液并加热:NH4++OH- ![]() NH3↑+H2O
NH3↑+H2O
B.铜和硝酸银溶液反应:Cu+Ag+=Cu2++Ag
C.向NaHSO4溶液中滴加Ba(OH)2溶液至SO42-离子恰好沉淀完全:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
D.NH4HCO3溶液与过量HCl溶液混合:HCO3-+H+=CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用活性炭还原法处理氮氧化物,有关反应为:C(s)+ 2NO(g)![]() N2(g)+ CO2(g)。某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2(g)+ CO2(g)。某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
时间min/ 浓度mol·L-1 | NO | N2 | CO2 |
0 | 1.00 | 0 | 0 |
10 | 0.58 | 0.21 | 0.21 |
20 | 0.40 | 0.30 | 0.30 |
30 | 0.40 | 0.30 | 0.30 |
40 | 0.32 | 0.34 | 0.17 |
50 | 0.32 | 0.34 | 0.17 |
(1) 10 min~20 min的时间段内,以CO2表示的反应速率为____;
(2)计算出该反应的平衡常数的值K=________;
(3) 下列各项能作为判断该反应达到平衡状态的是____ (填序号字母);
A.容器内压强保持不变 B.2v正(NO)= v逆(N2)
C.容器内CO2的体积分数不变 D.混合气体的密度保持不变
(4)30 min时改变某一条件,反应重新达到平衡,则改变的条件可能是_____________;
(5)一定温度下,随着NO的起始浓度增大,则NO的平衡转化率__________ (填“增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在同温同压下,下列各组热化学方程式中Q2 > Q1的是( )
A. 2H2(g)+O2(g)=2H2O(l) ΔH== -Q1 2H2(g)+O2(g)=2H2O(g) ΔH== - Q2
B. S(g)+O2(g)=SO2(g) ΔH== - Q1 S(s)+O2(g)=SO2(g) ΔH== - Q2
C. C(s)+![]() O2(g)=CO(g) ΔH== - Q1 C(s)+O2(g)=CO2(g) ΔH== - Q2
O2(g)=CO(g) ΔH== - Q1 C(s)+O2(g)=CO2(g) ΔH== - Q2
D. H2(g)+Cl2(g)=2HCl(g) ΔH== - Q1 ![]() H2(g)+
H2(g)+![]() Cl2(g)= HCl(g) ΔH== - Q2
Cl2(g)= HCl(g) ΔH== - Q2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以TiO2为催化剂的光热化学循环分解CO2反应为温室气体减排提供了一个新途径,该反应的机理及各分子化学键完全断裂时的能量变化如图所示。下列说法正确的是


A.过程①中钛氧键断裂会释放能量
B.CO2分解反应的热化学方程式为2CO2(g)=2CO(g)+O2(g)ΔH=+30kJ/mol
C.使用TiO2作催化剂可以降低反应的焓变,从而提高化学反应速率
D.该反应中,光能和热能转化为化学能
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com