
某氯化亚铁和氯化铁的混合物。现要测定其中铁元素的质量分数,按以下步骤进行实验: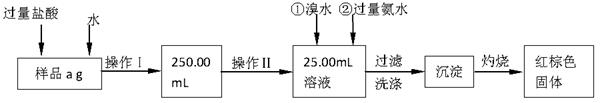
Ⅰ.请根据上面流程,回答以下问题:
(1)操作I所用到的玻璃仪器除烧杯、玻璃棒外,还必须有 、 。(填仪器名称)
(2)请写出加入溴水发生的离子反应方程式 。
(3)将沉淀物加热、灼烧,冷却至室温,用天平称量其质量为b1 g,再次加热并冷却至室温称量其质量为b2 g,若b1-b2=0.3g,则接下来还应进行的操作是 ;蒸发皿质量是W1 g,蒸发皿与加热后固体总质量是W2 g,则样品中铁元素的质量分数是 。
Ⅱ.有同学提出,还可以采用以下方法来测定: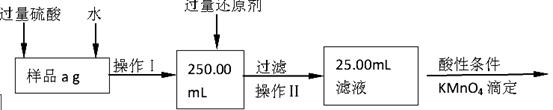
(1)溶解样品改用了硫酸,而不再用盐酸,为什么 ;
(2)选择的还原剂是否能用铁 (填“是”或“否”),原因是:
;
(3)若滴定用掉c mol?L-1 KMnO4溶液b mL,则样品中铁元素的质量分数是: 。
Ⅰ.(1)250mL容量瓶(1分)、胶头滴管(1分)
(2)2Fe 2++ Br2= 2Fe 3++ 2Br-(2分)
(3)再次加热冷却并称量,直至两次质量差小于0.1g(1分)
铁元素的质量分数是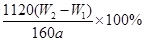 (2分)
(2分)
Ⅱ.(1)过量的盐酸对后面KMnO4的滴定有干扰(2分)
(2)否(1分)如果用铁做还原剂,自身的氧化产物是Fe2+;且会与过量的硫酸反应生成Fe2+,干扰铁元素的测定(2分,答出一个原因即给2分)
(3)铁元素的质量分数是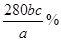 (2分)
(2分)
解析试题分析:I、该实验的原理是:先将样品配成一定浓度的溶液,然后取其中的十分之一,加氧化剂将二价铁氧化为三价铁,然后加碱使铁生成氢氧化铁沉淀,灼烧沉淀使其变为氧化物,通过称量氧化物的质量计算出铁的质量,进而得出铁的质量分数。
(1)配制一定物质的量浓度的溶液所需仪器除了烧杯、玻璃棒外,还需要胶头滴管和容量瓶,由框图中溶液体积为250.00mL,故容量瓶要注明规格。
(2)加入溴水的目的是将二价铁氧化为三价铁,故反应为:2Fe 2++ Br2= 2Fe 3++ 2Br-。
(3)将物质灼烧至恒重的标准是灼烧后连续两次称量质量差小于0.1g,但b1-b2=0.3g,因此还需要继续灼烧,直至两次质量差小于0.1g。灼烧后的固体为Fe2O3,其质量为:(W2—W1)g,其中铁的质量为: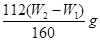 ,该质量为取样的十分之一,因此原样品中铁的质量分数为:
,该质量为取样的十分之一,因此原样品中铁的质量分数为: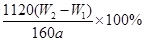 。
。
II、该实验的原理是将样品配成溶液,将其中的三价铁用还原剂还原为二价铁,取其十分之一,再用酸性高锰酸钾滴定二价铁,通过消耗的高锰酸钾的量计算出样品中铁的质量,进而求出铁的质量分数。
(1)盐酸中的Cl—具有还原性,可被高锰酸钾氧化,因此要将盐酸换为硫酸。
(2)若用铁作还原剂,发生的反应为Fe+2Fe3+=3Fe2+,Fe+H2SO4=FeSO4+H2↑,产生的Fe2+会干扰样品中铁的测量。
(3)二价铁被氧化为三价铁,每个Fe失去一个电子,KMnO4被还原为Mn2+,每个KMnO4得到5个电子,因此铁的物质的量是高锰酸钾物质的量的5倍,即n(Fe)=5×10-3bcmol,样品中铁的物质的量为5×10-2bcmol,故样品中铁的质量分数为: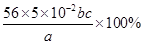 =
=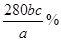 。
。
考点:考查化学实验常用仪器、基本操作,实验原理,实验流程分析,实验数据处理。


科目:高中化学 来源: 题型:实验题
某氯化亚铁和氯化铁的混合物。现要测定其中铁元素的质量分数,进行如下实验:
Ⅰ.甲同学根据如下流程进行实验,回答以下问题:
(1)操作Ⅰ所用到的玻璃仪器除烧杯、玻璃棒外,还必须有 、 (填仪器名称)
(2)请写出加入溴水发生的离子反应方程式 。
(3)将沉淀物置于坩埚中加热至恒重后,冷却至室温,称量剩余固体和坩埚的质量,计算。
实验中加热至恒重的目的是 。
(4)若坩埚质量是W1g,坩埚与加热后固体总质量是W2g,则样品中铁元素的质量分数是 。
Ⅱ.乙同学提出,还可以采用以下方法来测定: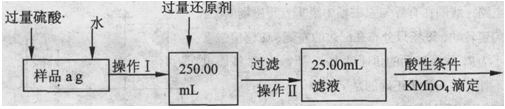
(1)溶解样品改用了硫酸,用离子方程式指明不再用盐酸原因是 ;
(2)若要用实验证明操作Ⅱ所得滤液中不存在Fe3+,其最可靠的化学方法是 ;
(3)若滴定用掉c mol/L KMn04溶液b mL,则样品中铁元素的质量分数是 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
铁矿石是工业炼铁的主要原料之一,其主要成分为铁的氧化物(设杂质中不含铁元素和氧元素,且杂质不与H2SO4反应)。某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究。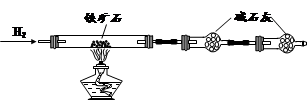
A B C
Ⅰ.铁矿石中含氧量的测定
① 按上图组装仪器,检查装置的气密性;
② 将5.0g铁矿石放入硬质玻璃管中,装置B、C中的药品如图所示(夹持仪器均省略);
③ 从左端导气管口处不断地缓缓通入H2,待C装置出口处H2验纯后,点燃A处酒精灯
④ 充分反应后,撤掉酒精灯,再持续通入氢气至完全冷却。
(1)装置C的作用为 。
(2)测的反应后装置B增重1.35g,则铁矿石中氧的百分含量为 。
Ⅱ.铁矿石中含铁量的测定
(1)步骤④中煮沸的作用是 。
(2)步骤⑤中用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、 。
(3)下列有关步骤⑥的操作中说法正确的是 。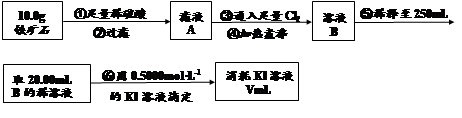
a.因为碘水为黄色,所以滴定过程中不需加指示剂
b.滴定过程中可利用淀粉溶液作为指示剂
c.滴定管用蒸馏水洗涤后可以直接装液
d.锥形瓶不需要用待测液润洗
e.滴定过程中,眼睛注视滴定管中液面变化
f.滴定结束后,30s内溶液不恢复原来的颜色再读数
(4)若滴定过程中消耗0.5000mol·L?1KI溶液20.00mL,则铁矿石中铁的百分含量为 。
Ⅲ.由Ⅰ、Ⅱ可以推算出该铁矿石中铁的氧化物的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
金属钠与水的反应是中学化学中的一个重要反应。在高中化学教材的几次改版中该实验曾出现过几种不同的演示方法,分别如下图中甲、乙、丙所示: 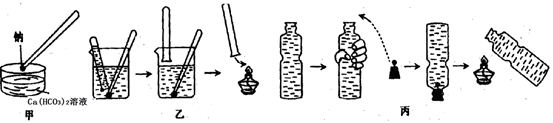
(1)现按图甲所示的方法,在室温时,向盛有Ca(HCO3)2溶液的水槽中,加入一小块金属钠。下列现象描述正确的是_________(填字母)。
A.钠浮在液面上,并四处游动,最后消失
B.钠熔化成一个光亮的小球
C.反应开始后,溶液由无色变红色
D.恢复到室温时,烧杯底部有固体物质析出
(2)请补充并完成甲实验中从试剂瓶中取出钠到向水槽中投入钠的有关操作:用镊子从试剂瓶中取出一小块钠→__________→用镊子夹取金属钠投入到盛有Ca(HCO3)2溶液的水槽中。
(3)按图乙所示方法来收集产生的气体,需将钠包好,再放入水中。取相同质量的钠按下列几种情况收集产生的气体在相同条件下体积最大的是 。
A.用铝箔包住钠 B.用锡箔包住钠 C.直接将钠投入的水中
(4)用装满水的矿泉水瓶按图丙方法进行实验,(用手挤压矿泉水瓶共排出水的体积为112 mL)塞紧带有钠的塞子,反应结束后,干瘪的带塞矿泉水瓶恰好恢复成原状,假设瓶内、瓶外均属于标准状况,则所用金属钠的质量是多少克?(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(1)实验室用二氧化锰跟浓盐酸反应制取氯气的离子方程式为 。
(2)高锰酸钾是常用氧化剂,在酸性条件下,MnO4-被还原成Mn2+,用高锰酸钾跟浓盐酸反应在室温下制氯气的离子方程式为 。
(3)历史上曾用“地康法”制氯气,这一方法是用CuCl2作催化剂,在450℃利用空气中的氧气跟氯化氢反应制氯气,反应的化学方程式为 。
(4)现有100 mL AlCl3与MgSO4的混合溶液,分成两等份。
① 向其中一份中加入10 mL 4 mol/L的氨水,恰好完全沉淀,其中AlCl3与氨水反应的离子方程式是 。继续加入1 mol/L NaOH溶液至10 mL时,沉淀不再减少,沉淀减少的离子方程式是 ,减少的沉淀的物质的量是 。
② 向另一份中加入a mL 1 mol/LBaCl2溶液能使SO42-沉淀完全,a= 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某研究性学习小组探究铁粉与水蒸气反应后的固体的组成,铁粉与水蒸气反应的化学方程式为 。
基于上述反应所得黑色固体粉末,研究性学习小组提出下列假设并欲做实验分析。
假设一:固体全部是Fe3O4
假设二:固体全部是Fe
假设三:固体是
取铁粉与水蒸气反应后的固体作为样品,进行如下实验探究。
探究1:取少量样品投入硫酸铜稀溶液中,若现象为 ,则假设一成立。
探究2:取1.68g样品在纯氧中灼烧后,若质量为 g,则假设二成立。
经过实验探究,假设一、二都不成立。
探究3:取样品4.00g进行如下实验。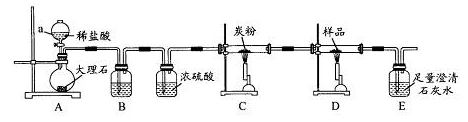
B中的溶液是 ;实验后经测定样品完全反应,D中剩余固体质量为3.36g,且测得E中沉淀质量为6.0g,则样品中Fe3O4的质量分数为 ;实验装置中有一明显缺陷是 。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某同学用下列装置制备并检验Cl2的性质: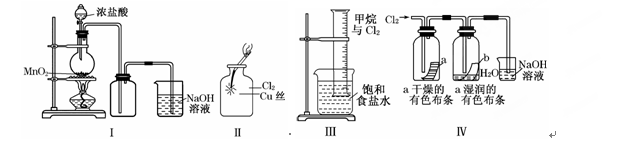
下列说法正确的是( )
| A.Ⅰ图中:如果MnO2过量,浓盐酸就可全部消耗完 |
| B.Ⅱ图中:生成蓝色的烟 |
| C.Ⅲ图中:量筒中发生了加成反应 |
| D.Ⅳ 图中湿润的有色布条能褪色,将浓硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
痕检是公安机关提取犯罪嫌疑人指纹的一种重要的方法,AgNO3显现法就是其中一种:人的手上有汗渍,用手动过白纸后,手指纹线就留在纸上。如果将溶液①小心涂到纸上,溶液①中的溶质就跟汗渍中的物质②作用,生成物质③,物质③在光照下,分解出的银粒呈灰褐色,随着反应的进行,银粒逐渐增多,由棕色变成黑色的指纹线。用下列化学式表示这三种物质都正确的是 ( )
| A.①AgNO3;②NaBr;③AgBr | B.①AgNO3;②NaCl;③AgCl |
| C.①AgCl; ②AgNO3;③NaCl | D.①AgNO3;②NaCl;③Ag |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com