
����Ŀ����ͼװ����ʾ��C��D��E��F��X��Y��Ϊ���Ե缫���ס�������Һ�����Ϊ500mL����ҺŨ�Ⱦ���ͬ(����ͨ��ǰ����Һ�������)��A��BΪ���ֱ����Դ����������ֱ����Դ��ͨ��F�������ʺ�ɫ����ش�

��1��B���ǵ�Դ��_____����һ��ʱ�������Һ��ɫ��____������X����������ɫ��dz��Y����������ɫ��������Fe(OH)3��������____�ɡ�
��2�����һ��ʱ���ס���װ���е�C��D��E��F�缫���ֱ�ֻ��һ�ֵ�������ʱ����Ӧ���ʵ����ʵ���֮��Ϊ______________�����з�����Ӧ�Ļ�ѧ����ʽΪ__________________________________����Ҫʹ����ļ�װ���е���Һ�ָ���ԭŨ���������һ������_________(�ѧʽ)��
��3�����ñ�װ�ø�ͭ����������HӦ����______(�����Ʋ�����������Ƽ���)�����Ƽ�������5.4g��ʱ�� �ס�������Һ��pH�ֱ�Ϊ_____��_____
���𰸡� �� dz �� 1:2:2:2 2NaCl��2H2O![]() 2NaOH��H2����Cl2�� CuO �Ƽ� 1 13
2NaOH��H2����Cl2�� CuO �Ƽ� 1 13
��������������������⿼���ش���װ�ã��漰װ�õķ���������ĵ�Ӿ���绯ѧ�ļ��㣬��ơ���ͨ��Դ��F�������ʺ�ɫ��FΪ������EΪ��������AΪ��Դ��������BΪ��Դ�ĸ�����
��1��B���ǵ�Դ�ĸ�����C��DΪ���Ե缫������ΪCuSO4��Һ�����е�ⷴӦ����ʽΪ2CuSO4+2H2O![]() 2Cu+2H2SO4+O2��������Cu2+Ũ�ȼ�С��������Һ����ɫ��dz������ͼʾXΪ������YΪ������Y����������ɫ�������Fe��OH��3������������ɡ�
2Cu+2H2SO4+O2��������Cu2+Ũ�ȼ�С��������Һ����ɫ��dz������ͼʾXΪ������YΪ������Y����������ɫ�������Fe��OH��3������������ɡ�
��2��CΪ������C���ĵ缫��ӦʽΪ4OH--4e-=O2��+2H2O��DΪ������D���ĵ缫��ӦʽΪCu2++2e-=Cu��EΪ������E���ĵ缫��ӦʽΪ2Cl--2e-=Cl2����FΪ������F���ĵ缫��ӦʽΪ2H++2e-=H2�������ݵ�·��ͨ���������ʵ�����ȣ�C��D��E��F���ɵĵ������ʵ���֮��Ϊ1:2:2:2�����з�����Ӧ�Ļ�ѧ����ʽΪ2NaCl+2H2O![]() 2NaOH+H2��+Cl2������װ���з����ķ�ӦΪ2CuSO4+2H2O
2NaOH+H2��+Cl2������װ���з����ķ�ӦΪ2CuSO4+2H2O![]() 2Cu+2H2SO4+O2��������ԭ���غ㣬Ҫʹ��װ���е���Һ�ָ���ԭŨ�������һ������CuO��
2Cu+2H2SO4+O2��������ԭ���غ㣬Ҫʹ��װ���е���Һ�ָ���ԭŨ�������һ������CuO��
��3����װ����GΪ������HΪ���������ݵ��ԭ������ͭ��������HΪ�Ƽ����Ƽ��ϵĵ缫��ӦʽΪAg++e-=Ag��n��Ag��=![]() =0.05mol����·��ͨ���ĵ������ʵ���Ϊ0.05mol�����з�ӦΪ2Cu2++2H2O
=0.05mol����·��ͨ���ĵ������ʵ���Ϊ0.05mol�����з�ӦΪ2Cu2++2H2O![]() 2Cu+4H++O2��~4e-����������n��H+��=n��e-��=0.05mol��c��H+��=
2Cu+4H++O2��~4e-����������n��H+��=n��e-��=0.05mol��c��H+��=![]() =0.1mol/L��������Һ��pH=1�����з�ӦΪ2Cl-+2H2O
=0.1mol/L��������Һ��pH=1�����з�ӦΪ2Cl-+2H2O![]() 2OH-+H2��+Cl2��~2e-����������n��OH-��=n��e-��=0.05mol��c��OH-��=
2OH-+H2��+Cl2��~2e-����������n��OH-��=n��e-��=0.05mol��c��OH-��=![]() =0.1mol/L��c��H+��=1
=0.1mol/L��c��H+��=1![]() 10-13mol/L��������Һ��pH=13��
10-13mol/L��������Һ��pH=13��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25 �棬ijpH��2��HCl��Һ�У���ˮ�����c(H+)Ϊ(����)
A. 1.0��10��12mol��L��1 B. 1.0��10��7mol��L��1 C. 1.0��10��10mol��L��1 D. 1.0��10��2mol��L��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ����c(CH3COOH)��c(CH3COO-)=0.1mol/L��һ��CH3COOH��CH3COONa�Ļ����Һ����Һ��c(CH3COOH)��c(CH3COO-����pH�Ĺ�ϵ��ͼ��ʾ�������й���Һ������Ũ�ȹ�ϵ��������ȷ����( )

A. pH=3.5����Һ�У�c(Na+)��c(H+)-c(OH-)��c(CH3COOH)=0.1mol/L
B. pH=5.5����Һ�У�c(CH3COOH)��c(CH3COO-)��c(H+)��c(OH-)
C. W������ʾ����Һ�У�c(H+)=c(CH3COOH)��c(OH-)
D. ��W������ʾ��1.0L��Һ��ͨ��0.05molHCl����(��Һ����仯�ɺ���)��c(H+)=c(CH3COOH)��c(OH-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ClO2��һ������ɱ��Ч�ʸߡ�������ȾС��ˮ��������ʵ���ҿ�ͨ�����·�Ӧ�Ƶ�ClO2��2KClO3��H2C2O4��H2SO4![]() 2ClO2����K2SO4��2CO2����2H2O������˵����ȷ���� ��
2ClO2����K2SO4��2CO2����2H2O������˵����ȷ���� ��
A. 1 molKClO3�μӷ�Ӧ��1mole- ת�� B. ClO2����������
C. H2C2O4�ڷ�Ӧ�б���ԭ D. KClO3�ڷ�Ӧ�еõ����ӣ�����ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ������Ƭ��������ȡH2�Ļ�ѧ��Ӧ���ʣ����д�ʩ�в��ܴﵽĿ�ĵ���
A.�����۴�����ƬB.��Ũ�������ϡ����
C.��Ӧ��ϵ�еμ�����CuSO4��ҺD.�ʵ�������Һ�¶�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ԭ����ԭ���ԭ���ǵ绯ѧ��������Ҫ���ݣ�ij��ȤС��������̽��ʵ�飺

��1����ͼ1Ϊijʵ��С������������ԭ��Ӧ��Ƶ�ԭ���װ�ã��÷�Ӧ�����ӷ���ʽΪ__________________����Ӧǰ���缫������ȣ�һ��ʱ������缫�������15g��������ͨ��__mol���ӣ�
��2����ͼ1�������������䣬����CuCl2��Һ��ΪNH4Cl��Һ��ʯī�缫�ĵ缫��ӦʽΪ___________________________________����������NH4Cl��Һ��____�ԣ������ӷ���ʽ��ʾ��Һ�Դ��Ե�ԭ��__________________________________________
��3����ͼ2�������������䣬�������Ż�����ͭ������ʯī���������ͣ�����װ����ʯī�缫(1)Ϊ__������װ����ͭ�缫�ϵ缫��ӦʽΪ_____
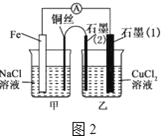
��4����ͼ2��װ���и�Ϊ����400mL CuSO4��Һ��һ��ʱ������缫��������1.28g�����ʱ��Һ��pHΪ__
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У���ȷ����
A. H2SO4��Ħ��������98
B. ��������O2��O3����������ԭ������ͬ
C. ��������CO��CO2������̼ԭ����֮��Ϊ7�U11
D. 98g H2SO4�ܽ���500mLˮ�У�������Һ����������ʵ���Ũ��Ϊ2 mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������һ���л��ϳ��м��壬��ҵ�Ϻϳɶ��������Ļ�ѧ����ʽΪ![]() ������˵������ȷ����( )
������˵������ȷ����( )
A. ������Ӧ����ȡ����Ӧ
B. ��������������������16��ԭ�ӹ�ƽ��
C. ����������һ��ȡ������4��
D. 0.2 mol������������������������ȫȼ������5.1 mol O2
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com