
【题目】电解原理和原电池原理是电化学的两个重要内容.某兴趣小组做如下探究实验:

(1)如图1为某实验小组依据氧化还原反应设计的原电池装置,该反应的离子方程式为__________________,反应前两电极质量相等,一段时间后,两电极质量相差15g,导线中通过__mol电子.
(2)如图1,其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极的电极反应式为___________________________________,这是由于NH4Cl溶液显____性,用离子方程式表示溶液显此性的原因__________________________________________
(3)如图2,其他条件不变,若将盐桥换成弯铜导线与石墨相连成∩型,则乙装置中石墨电极(1)为__极,甲装置中铜电极上电极反应式为_____
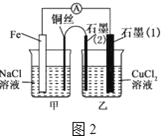
(4)如图2乙装置中改为加入400mL CuSO4溶液,一段时间后,若电极质量增重1.28g,则此时溶液的pH为__
【答案】 Fe+Cu2+==Cu+Fe2+ 0.25 2H++2e- == H2↑或 2NH4++2e-==H2↑+2NH3 酸 NH4++H2O![]() NH3·H2O+H+ 阴 O2+4e-+2H2O==4OH- 1
NH3·H2O+H+ 阴 O2+4e-+2H2O==4OH- 1
【解析】试题分析:本题考查原电池原理和电解池原理,电化学的有关计算。
(1)Fe为负极,Fe极的电极反应式为Fe-2e-=Fe2+,石墨为正极,石墨极的电极反应式为Cu2++2e-=Cu,反应的离子方程式为Fe+Cu2+=Fe2++Cu。若反应前两电极质量相等,根据电子守恒,电路中每通过2mol电子,负极减少1molFe(56gFe),正极增加1molCu(64gCu),即电路中每通过2mol电子,两极质量相差56g+64g=120g,则两极质量相差15g时导线中通过的电子为![]() 2mol=0.25mol。
2mol=0.25mol。
(2)若将CuCl2溶液换为NH4Cl溶液,石墨为正极,石墨电极的电极反应式为2H++2e-=H2↑(或2NH4++2e-=H2↑+2NH3)。NH4Cl属于强酸弱碱盐,由于NH4+的水解,NH4Cl溶液呈酸性,NH4+水解的离子方程式为NH4++H2O![]() NH3·H2O+H+。
NH3·H2O+H+。
(3)其他条件不变,若将盐桥换成弯铜导线与石墨相连成∩型,此时甲装置为原电池,乙装置为电解池,由于Fe比Cu活泼,甲装置中Fe为负极,Cu为正极,则乙装置中的石墨(1)为阴极,石墨(2)为阳极。甲装置中溶液为NaCl溶液,溶液呈中性,甲为铁的吸氧腐蚀,Cu极的电极反应式为O2+4e-+2H2O=4OH-。
(4)如图2乙装置中改为加入400mL CuSO4溶液,装置乙中电解的离子方程式为2Cu2++2H2O![]() 2Cu+4H++O2↑,若电极质量增重1.28g即n(Cu)=
2Cu+4H++O2↑,若电极质量增重1.28g即n(Cu)=![]() =0.02mol,则反应生成n(H+)=0.04mol,c(H+)=
=0.02mol,则反应生成n(H+)=0.04mol,c(H+)=![]() =0.1mol/L,溶液的pH=-lgc(H+)=1。
=0.1mol/L,溶液的pH=-lgc(H+)=1。


科目:高中化学 来源: 题型:
【题目】“飘尘”是物质燃烧时产生的粒子漂浮物,颗粒很小(直径小于10-7m),不易沉降(可漂浮数小时或数年),它与空气中SO2、O2接触时,SO2部分转化为SO3,使空气酸度增加,形成酸雨。
(1)飘尘所起的主要作用是____。
A.氧化剂 B.催化剂 C.吸附剂 D.还原剂
(2)与雨水形成酸雨,试写出这两个化学反应式:_____________。
(3)汽车排放的尾气、硝酸厂和化肥厂的废气含有氮氧化物,全世界每年排放量约5×107kgNO2溶于水生成___________酸。
(4)酸雨可导致下列哪种危害____。
A.腐蚀建筑物 B.导致树木枯萎
C.造成洪涝灾害 D.恶化人类环境
(5)人体中纯净的胃液是一种强酸性液体,pH在0.9---1.5之间。氢氧化铝是一种治疗胃酸过多的胃药主要成分,目前这种胃药已不常用,主要原因是____。
A.它不能中和胃酸 B.它的疗效太差
C.长期摄入铝元素不利于身体健康 D.它不易溶于胃酸
(6)制造焊锡时,把铅加入锡的主要原因是____。
A.增加抗腐蚀能力 B.降低熔点
C.增加延展性 D.增加硬度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1mol/L的盐酸滴定0.1mol/L的Na2CO3溶液25mL。测得溶液pH变化曲线如图,下列说法正确的是( )
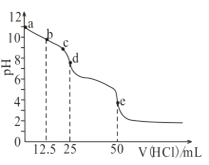
A. b点时,c(CO32-)>c(HCO3-)>c(OH-)
B. d点时,c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
C. e点时,c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
D. c→d发生的主要离子反应:H++HCO3-=CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置所示,C、D、E、F、X、Y均为惰性电极,甲、乙中溶液体积均为500mL且溶液浓度均相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.请回答:

(1)B极是电源的_____极,一段时间后,甲中溶液颜色逐渐变____,丁中X极附近的颜色逐渐变浅,Y极附近的颜色逐渐变深,这表明Fe(OH)3胶体微粒带____荷。
(2)电解一段时间后甲、乙装置中的C、D、E、F电极均分别只有一种单质生成时,对应单质的物质的量之比为______________,乙中发生反应的化学方程式为__________________________________,若要使电解后的甲装置中的溶液恢复到原浓度则需加入一定量的_________(填化学式)。
(3)现用丙装置给铜件镀银,则H应该是______(填“镀层金属”或“镀件”),当镀件上析出5.4g银时, 甲、乙中溶液的pH分别为_____和_____
查看答案和解析>>
科目:高中化学 来源: 题型:
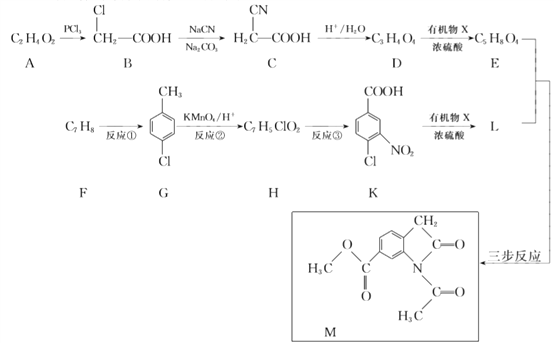
【题目】合成药物中间体M的流程如下。
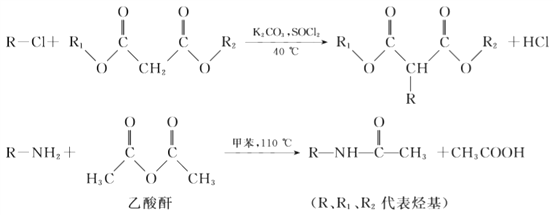
已知:
(1)A的名称是________。
(2)B中含有的官能团是________。
(3)D的结构简式是________。
(4)反应①的化学方程式是________。
(5)反应②的反应类型是________。
(6)反应③的试剂和条件是________。
(7)由K生成L反应的化学方程式是________
(8)
写出中间产物的结构简式: 中间产物Ⅰ ______ , 中间产物Ⅱ ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请把符合要求的化学方程式的序号填在下列横线处:
①既属于分解反应又是氧化还原反应的是__________。
②属于化合反应,但不是氧化还原反应的是__________。
③既属于化合反应又是氧化还原反应的是__________。
④属于分解反应,但不是氧化还原反应的是__________。
⑤不属于四种基本反应类型,但属于氧化还原反应的是__________。
A.2NaHCO3![]() Na2CO3 +H2O+CO2↑B.2Na + Cl2
Na2CO3 +H2O+CO2↑B.2Na + Cl2![]() 2NaCl
2NaCl
C.Zn + CuSO4![]() ZnSO4 + CuD.2KMnO4
ZnSO4 + CuD.2KMnO4![]() K2MnO4 + MnO2 + O2↑
K2MnO4 + MnO2 + O2↑
E.CaO + CO2![]() CaCO3F.4FeS2 +11O2
CaCO3F.4FeS2 +11O2![]() 2Fe2O3 +8SO2
2Fe2O3 +8SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】古诗是古人为我们留下的宝贵精神财富。下列诗句中不涉及氧化还原反应的是
A.野火烧不尽,春风吹又生B.粉身碎骨浑不怕,要留清白在人间
C.春蚕到死丝方尽,蜡炬成灰泪始干D.爆竹声中一岁除,春风送暖入屠苏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】久置的氯水和新制的氯水相比较,下列结论正确的是
A. 颜色相同 B. 都能使有色布条褪色
C. pH相同 D. 加AgNO3溶液都能生成白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列实验所选择的装置或仪器(夹持装置已略去)正确的是
选项 | A | B | C | D |
实验 | 用CCl4提取溴水中的Br2 | 从食盐水中提取NaCl固体 | 从KI和I2的固体混合物中回收I2 | 配制100 mL 0.100 0 mol·L-1 K2Cr2O7溶液 |
装置或仪器 |
|
|
|
|
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com