
【题目】古诗是古人为我们留下的宝贵精神财富。下列诗句中不涉及氧化还原反应的是
A.野火烧不尽,春风吹又生B.粉身碎骨浑不怕,要留清白在人间
C.春蚕到死丝方尽,蜡炬成灰泪始干D.爆竹声中一岁除,春风送暖入屠苏
 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ实验室里需要纯净的氯化钠溶液,但实验室只有混有硫酸钠、碳酸氢铵的氯化钠.某学生设计了如下方案进行提纯:
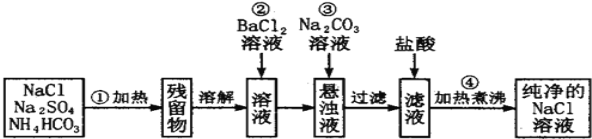
(1)操作②能否改为加硝酸钡溶液,______(填“能”或“否”) ,理由_____________________________。
(2)进行操作②后,如何判断SO42- 已除尽,方法是___________________。
(3)操作④的目的是_______________________________。
Ⅱ硫酸亚铁铵(NH4)2SO4·FeSO4·6H2O为浅绿色晶体,实验室中常以废铁屑为原料来制备,其步骤如下:
步骤1 将废铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑。
步骤2 向处理过的铁屑中加入过量的3mol/L H2SO4溶液,在60℃左右使其反应到不再产生气体,趁热过滤,得FeSO4溶液。
步骤3 向所得FeSO4溶液中加入饱和(NH4)2SO4溶液,经过“一系列操作”后得到硫酸亚铁铵晶体。
请回答下列问题:
(1)在步骤1中,分离操作,所用到的玻璃仪器有___________________________。(填仪器编号)
①漏斗 ②分液漏斗 ③烧杯 ④广口瓶 ⑤铁架台 ⑥玻璃棒 ⑦酒精灯
(2)在步骤3中,“一系列操作”依次为_____________________、_______________________和过滤。
(3)实验室欲用18mol/L H2SO4来配制240mL 3mol/L H2SO4溶液,需要量取________mL浓硫酸,实验时,下列操作会造成所配溶液浓度偏低的是__________________。(填字母)
a.容量瓶内壁附有水珠而未干燥处理 b.未冷却至室温直接转移至容量瓶中
c.加水时超过刻度线后又倒出 d.定容时仰视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法正确的( )
2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法正确的( )
A. 1 molKClO3参加反应有1mole- 转移 B. ClO2是氧化产物
C. H2C2O4在反应中被还原 D. KClO3在反应中得到电子,作还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理和原电池原理是电化学的两个重要内容.某兴趣小组做如下探究实验:

(1)如图1为某实验小组依据氧化还原反应设计的原电池装置,该反应的离子方程式为__________________,反应前两电极质量相等,一段时间后,两电极质量相差15g,导线中通过__mol电子.
(2)如图1,其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极的电极反应式为___________________________________,这是由于NH4Cl溶液显____性,用离子方程式表示溶液显此性的原因__________________________________________
(3)如图2,其他条件不变,若将盐桥换成弯铜导线与石墨相连成∩型,则乙装置中石墨电极(1)为__极,甲装置中铜电极上电极反应式为_____
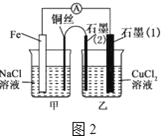
(4)如图2乙装置中改为加入400mL CuSO4溶液,一段时间后,若电极质量增重1.28g,则此时溶液的pH为__
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,正确的是
A. H2SO4的摩尔质量是98
B. 等质量的O2和O3中所含的氧原子数相同
C. 等质量的CO与CO2中所含碳原子数之比为7︰11
D. 98g H2SO4溶解于500mL水中,所得溶液中硫酸的物质的量浓度为2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)基态Si原子中,电子占据的最高能层符号为________,该能层具有的原子轨道数为________,Si原子在该层上的电子数为__________。
(2)按照构造原理, 35号元素基态原子的简化电子排布式为_______________,其核外有________个能层;最外层电子数是____________。
(3)Cu原子序数为________,其核外价层电子的排布式为_______________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】因瓦合金是铁和镍的合金,由于其膨胀系数极小,又称不变合金,适合做测量元件。回答下列问题:
(1)基态镍原子的价电子轨道表达式为_______;铁的基态原子核外未成对电子数为_______个。
(2)在稀氨水介质中,Ni2+与丁二酮肟(分子式为C4H8N2O2)反应可生成鲜红色沉淀,其分子结构如下图所示,该结构中碳原子的杂化方式为_______;已知丁二酮肟分子结构中C-C键与N-O键的键长和键能数据如下表所示,请从原子结构角度解释N-O键的键能小于C-C键:_______。
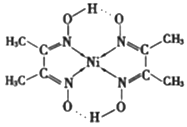
化学键 | 键长 (10-12m) | 键能 (kJ/mol) |
C-C | 154 | 332 |
N-O | 146 | 230 |
(3)铁、镍易与CO作用形成羰基配合物Fe(CO)5、N(CO)4。1个Fe(CO)5分子中含有σ键数目为_______;已知Ni(CO)4分子为正四面体构型,下列溶剂能够溶解Ni(CO)4的是_______(填写字母)。
A.四氯化碳 B.苯 C.水 D.液氨
(4)镍晶胞为面心立方,其中镍原子的配位数为_______。氯化亚铁的熔点为674℃,而氯化铁的熔点仅为282℃,二者熔点存在差异的原因是_______。
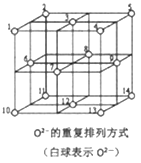
(5)Fe3O4晶体中,O2-的重复排列方式如右图所示,该排列方式中存在着由如1、3、6、7的O2-围成的正四面体空隙和3、6、7、8、9、12的O2-围成的正八面体空隙。Fe3O4中有一半的Fe3+填充在正四面体空隙中,另一半Fe3+和Fe2+填充在正八面体空隙中,则Fe3O4晶体中,正四面体空隙数与O2-数之比为_______。Fe3O4晶胞中有8个图示结构单元,晶体密度为5.18g/cm3,则该晶胞参数a=_______cm(写出计算表达式即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com