
����Ŀ����Ʈ����������ȼ��ʱ����������Ư���������С��ֱ��С�ڣ���-7���������׳�������Ư����Сʱ�����꣩�����������SO2��O2�Ӵ�ʱ��SO2����ת��ΪSO3��ʹ����������ӣ��γ����ꡣ
��1��Ʈ���������Ҫ������____��
A����������������B����������������C����������������D����ԭ��
��2������ˮ�γ����꣬��д����������ѧ��Ӧʽ��_____________��
��3�������ŷŵ�β�������᳧�ͻ��ʳ��ķ������е������ȫ����ÿ���ŷ���Լ5��107kgNO2����ˮ����___________�ᡣ
��4������ɵ�����������Σ��____��
A����ʴ������ ������������B��������ľ��ή
C����ɺ����ֺ�������������D���������
��5�������д�����θҺ��һ��ǿ����Һ�壬pH��0.9---1.5֮�䡣����������һ������θ������θҩ��Ҫ�ɷ֣�Ŀǰ����θҩ�Ѳ����ã���Ҫԭ����____��
A���������к�θ�ᡡ���������� B��������Ч̫��
C������������Ԫ�ز��������彡������D������������θ��
��6�����캸��ʱ����Ǧ����������Ҫԭ����____��
A�����ӿ���ʴ����������������B�������۵�
C��������չ�ԡ���������������D������Ӳ��
���𰸡� B 2SO2+O2![]() 2SO3 SO3+H2O��H2SO4 �� ABD C B
2SO3 SO3+H2O��H2SO4 �� ABD C B
����������1��SO2ת����SO3�Ĺ����У�SO2������е�O2������Ӧ��Ʈ��ֻ�����˼ӿ췴Ӧ�����ã������������ʺ�������δ�����ı䣬��ˣ�Ʈ���ڱ仯��������ã���ѡB����2��SO2��O2�ڴ���������������������Ӧ����ʽΪ2SO2+O2![]() 2SO3������������ˮ��Ӧ�������ᣬ��Ӧ�ķ���ʽΪ��SO3+H2O��H2SO4����3������������ˮ��Ӧ�������ᣬ��3NO2+H2O=2HNO3+NO����4������ɵ��µ�Σ���У����Ը�ʴ�����������ľ��ή��Ӱ��ũ������������ѡABD����5��AlԪ�ز�����������Ԫ�أ���������AlԪ�ػ�����������½������մ�֢��Ӱ���ͯ���������ȣ���������AlԪ�ز��������彡������ѡC����6����Ͻ��۵�ȳɷֽ����ͣ��������캸��ʱ����Ǧ����������Ҫԭ���ǽ����۵㣬��ѡB��
2SO3������������ˮ��Ӧ�������ᣬ��Ӧ�ķ���ʽΪ��SO3+H2O��H2SO4����3������������ˮ��Ӧ�������ᣬ��3NO2+H2O=2HNO3+NO����4������ɵ��µ�Σ���У����Ը�ʴ�����������ľ��ή��Ӱ��ũ������������ѡABD����5��AlԪ�ز�����������Ԫ�أ���������AlԪ�ػ�����������½������մ�֢��Ӱ���ͯ���������ȣ���������AlԪ�ز��������彡������ѡC����6����Ͻ��۵�ȳɷֽ����ͣ��������캸��ʱ����Ǧ����������Ҫԭ���ǽ����۵㣬��ѡB��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й����������ʵ������У�����ȷ����
A.S������ɫ����B.Cl2����������C.HCl��ֻ������D.Na������ɫ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����;�����ˮ��ʪ���ܡ���ҵ���ɱ�ϩ�Ʊ����͵�����֮һ����:
![]()
����˵������ȷ����
A. �٢ڢ۾�Ϊȡ����Ӧ
B. CH2ClCHClCH2Cl��ͬ���칹����5��(���������칹)
C. ������4���л������ʹ���CCl4��Һ��ɫ
D. CH2=CHCH2Cl��CH3CH=CH2���Ӿ�������6��ԭ�ӹ�ƽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.1mol/L��CH3COOH��Һ�У�Ҫ�ٽ����������������Ũ������Ӧ��ȡ�Ĵ�ʩ��( )
A. ���� B. ���� C. ����NaOH��Һ D. ����ϡHCl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʵ��������Ҫ�������Ȼ�����Һ,��ʵ����ֻ�л��������ơ�̼����淋��Ȼ���.ijѧ����������·��������ᴿ:
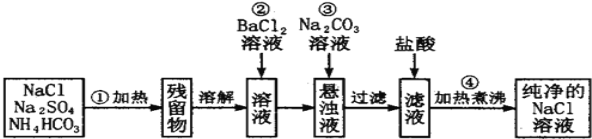
(1)�������ܷ��Ϊ�����ᱵ��Һ��______(��ܡ���) ������_____________________________��
(2)���в����ں�,����ж�SO42- �ѳ���,������___________________��
(3)�����ܵ�Ŀ����_______________________________��
�����������(NH4)2SO4��FeSO4��6H2OΪdz��ɫ���壬ʵ�����г��Է���мΪԭ�����Ʊ����䲽�����£�
����1 ������м����̼������Һ����г����ۣ������Һ�壬��ˮϴ����м��
����2 ����������м�м��������3mol/L H2SO4��Һ����60������ʹ�䷴Ӧ�����ٲ������壬���ȹ��ˣ���FeSO4��Һ��
����3 ������FeSO4��Һ�м��뱥��(NH4)2SO4��Һ��������һϵ�в�������õ���������茶��塣
��ش��������⣺
(1)�ڲ���1�У�������������õ��IJ���������___________________________������������ţ�
��©�� �ڷ�Һ©�� ���ձ� �ܹ��ƿ ������̨ ������ �߾ƾ���
(2)�ڲ���3�У���һϵ�в���������Ϊ_____________________��_______________________���ˡ�
(3)ʵ��������18mol/L H2SO4������240mL 3mol/L H2SO4��Һ����Ҫ��ȡ________mLŨ���ᣬʵ��ʱ�����в��������������ҺŨ��ƫ�͵���__________________��(����ĸ)
a.����ƿ�ڱڸ���ˮ���δ���ﴦ�� b.δ��ȴ������ֱ��ת��������ƿ��
c.��ˮʱ�����̶��ߺ��ֵ��� d.����ʱ���ӿ̶���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25 �棬ijpH��2��HCl��Һ�У���ˮ�����c(H+)Ϊ(����)
A. 1.0��10��12mol��L��1 B. 1.0��10��7mol��L��1 C. 1.0��10��10mol��L��1 D. 1.0��10��2mol��L��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ԭ����ԭ���ԭ���ǵ绯ѧ��������Ҫ���ݣ�ij��ȤС��������̽��ʵ�飺

��1����ͼ1Ϊijʵ��С������������ԭ��Ӧ��Ƶ�ԭ���װ�ã��÷�Ӧ�����ӷ���ʽΪ__________________����Ӧǰ���缫������ȣ�һ��ʱ������缫�������15g��������ͨ��__mol���ӣ�
��2����ͼ1�������������䣬����CuCl2��Һ��ΪNH4Cl��Һ��ʯī�缫�ĵ缫��ӦʽΪ___________________________________����������NH4Cl��Һ��____�ԣ������ӷ���ʽ��ʾ��Һ�Դ��Ե�ԭ��__________________________________________
��3����ͼ2�������������䣬�������Ż�����ͭ������ʯī���������ͣ�����װ����ʯī�缫(1)Ϊ__������װ����ͭ�缫�ϵ缫��ӦʽΪ_____
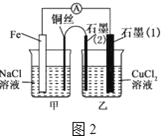
��4����ͼ2��װ���и�Ϊ����400mL CuSO4��Һ��һ��ʱ������缫��������1.28g�����ʱ��Һ��pHΪ__
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com