
【题目】下列物质均可用作燃料电池的燃料,其中最环保的是
A. 氢气 B. 甲烷 C. 甲醇 D. 汽油
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
【题目】(1)芒硝的化学式是_________________。
(2)以氯化钠、石灰石、水为原料制取漂白粉,写出有关反应的化学方程式。
①______________________________;②_________________________________;
③______________________________;④_________________________________。
(3)元素铬(Cr)在溶液中主要以Cr3+、Cr2O72—(橙红色)、CrO42—(黄色)CrO2—等形式存在。回答下列问题:
①![]() 与
与![]() 的化学性质相似。写出向
的化学性质相似。写出向![]() 溶液中加入过量
溶液中加入过量![]() 溶液反应的离子方程式_____________________________________________。
溶液反应的离子方程式_____________________________________________。
②![]() 价铬的化合物毒性较大,常用
价铬的化合物毒性较大,常用![]() 将废液中的
将废液中的![]() 还原成
还原成![]() ,该反应的离子方程式为 ______________________________________________________。
,该反应的离子方程式为 ______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质结构概念的判断正确的是( )
A.离子键:阴阳离子间的静电吸引作用
B.离子化合物:只含离子键的物质
C.共价键:通过共用电子对产生的作用
D.共价化合物:含有共价键的物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙(CaO2)是一种对环境友好的多功能无机化合物,通常有两种制备方法. 已知:温度过高过氧化钙会分解生成氧化物和氧气.
【方法1】由Ca(OH)2为原料最终制得,其制备流程如下:
【方法2】由鸡蛋壳(含CaCO3高达90%)为原料最终反应制得,其制备流程如下:
(1)方法1中搅拌的目的是;请将搅拌过程中发生反应的化学方程式补充完整:CaCl2+H2O2+2NH3H2O+6═CaO28H2O↓+2NH4Cl;制备过程中除水外可循环使用的物质是(填化学式).
(2)方法2中气体X是 , 实验室常用溶液来检验;煅烧后的反应是化合反应,也能生成CaO28H2O,反应的化学方程式为;该反应需控制温度在0~2℃,可将反应器放置在中,获得CaO2产品中主要含有的固体杂质是(填化学式).
(3)这两种制法均要求在低温下进行(除煅烧外),温度过高除了防止氨水挥发外,还能
(4)“绿色化学”一般是指反应物的原子全部转化为期望的最终产物,则上述两种方法中生成CaO28H2O的反应符合“绿色化学”的是(填“方法1”或“方法2”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请完成下列物质的分离提纯问题。
Ⅰ.现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂除去溶液中的NaCl和Na2SO4,从而得到纯净的NaNO3溶液。相应的实验过程可用下图表示:
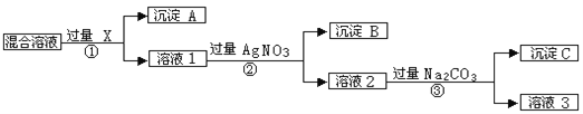
请回答下列问题:
(1)写出实验流程中下列物质的化学式:试剂X_______。
(2)证明AgNO3溶液加过量的实验方是_____________________________________________ 。(3)按此实验方案得到的溶液3中肯定含有__________(填化学式)杂质;为了解决这个问题,可以向溶液3中加入适量的___________(填化学式),之后若要获得固体NaNO3需进行的实验操作是___________(填操作名称)。
Ⅱ.某同学欲用CCl4萃取较高浓度的碘水中的碘,操作过程可以分解为如下几步:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.把50ml碘水和15mlCCl4加入分液漏斗中,并盖好玻璃塞;
C.检验分液漏斗活塞和上口的玻璃塞是否漏液;
D.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正
E.旋开活塞,用烧杯接收溶液;
F.从分液漏斗上口倒出上层液体;
G.将漏斗上口的玻璃塞打开或使塞上的凹槽与漏斗上口的小孔对准;
H.静置、分层。
(1)萃取过程正确操作步骤的顺序是:_________________________________ (填编号字母)。
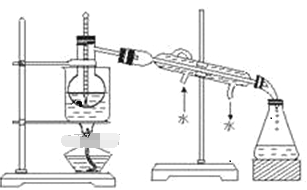
(2)从含碘的CCl4溶液中提取碘 和回收CCl4,还需要经过蒸馏,观察下图所示实验装置指出其错误有______ 处。
(3)进行上述蒸馏操作时,最后晶态碘在____________(填仪器名称)里聚集。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质间的转化,能通过一步反应实现的是:
A. HClO→CO2 B. Fe→FeCl2 C. CuO→Cu(OH)2 D. SiO2→H2SiO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示是验证氯气性质的微型实验,a、b、c、d、e是浸有相关溶液的滤纸。已知:KMnO4+ 16HC1=2KCl+5Cl2↑ +2MnCl2+8H2O,向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。

下列有关说法正确的是
A. a处变蓝、b处变棕红说明非金属性:C12> Br2 > I2
B. c处先变红、后褪色说明Cl2与H2O反应生成HC1
C. d处立即褪色说明Cl2与H2O反应生成HCIO
D. e处变红说明Cl2与Fe2+反应生成Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素①~⑧在元素周期表中的位置如下,回答有关问题: 
(1)画出⑦的原子结构示意图 .
(2)写出②含有10个中子的核素的化学符号 .
(3)已知元素的非金属性:②<③,则氢化物的稳定性由强到弱的顺序为(填化学式).
(4)请写出①的氢化物发生催化氧化的化学方程式 .
(5)表中能形成两性氢氧化物的元素是(填元素符号),写出该元素的单质与⑧的最高价氧化物的水化物反应的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐在能源、环保等方面有着广泛的用途,高铁酸钾在异丙醇中溶解度非常小。湿法、干法制备高铁酸盐的原理如下表所示。
湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如图所示:

①洗涤粗品时选用异丙醇而不用水的理由是__________________________________。
②反应Ⅱ的离子方程式为__________________________________________________。
③已知25 ℃时Fe(OH)3的Ksp=4.0×10-38,反应Ⅱ后的溶液中c(Fe3+)=4.0×10-5 mol/L,则需要调整pH=_______ 时,开始生成Fe(OH)3(不考虑溶液体积的变化)。
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠中加入饱和KOH溶液,即可析出高铁酸钾,析出后溶液中c(K+)<c(Na+)。由以上信息可知______(填字母)。
A.高铁酸钾的溶解度比高铁酸钠大 B.Ksp(K2FeO4)<Ksp(Na2FeO4)
(3)干法制备K2FeO4的反应中氧化剂与还原剂的物质的量之比为__________________。
(4) 锌-锰碱性电池以KOH溶液为电解液,电池总反应式为:
Zn(s)+2MnO2(s)+2H2O(l)═Zn(OH)2(s)+2MnOOH(s)。
Zn--K2FeO4 也可以组成碱性电池,与 Zn--MnO2电池类似。K2FeO4在电池中作正极材料,其电极反应式为__________________________________________________________,该电池总反应的离子方程式为___________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com