
【题目】实验室要制取氨气并完成喷泉实验。

(1)实验室选用图Ⅰ装置来制取氨气,试剂有:①NH4Cl(s) ②Ca(OH)2(s) ③NH4NO3(s) ④浓氨水 ⑤氢氧化钠溶液 ⑥CaO(s)。最合适的试剂是(填编号)___________。
(2)收集氨气应使用________法,要得到干燥的氨气可选用__________作干燥剂。
(3)用图Ⅱ装置进行喷泉实验,上部烧瓶已装满氨气,引发水上喷的操作是________________________,该实验的原理是___________________。
(4)如果只提供如图Ⅲ的装置,请说明引发喷泉的方法:_______________________。
(5)如图Ⅱ的装置有3个,烧瓶中分别盛有:①纯氨气、②含有1/10空气的氨气、③纯二氧化氮,在同温下分别进行喷泉实验,理论上得到的溶液物质的量浓度为(____)
A.①=②=③ B.①>②>③ C.①>③>② D.②>①>③
【答案】 ④⑥ 向下排空气法 碱石灰 打开止水夹,挤出胶头滴管中的水 氨气极易溶于水,致使烧瓶内气体压强迅速减小 打开夹子,①用手(或热毛巾)捂热烧瓶,氨气受热膨胀,赶出玻璃导管内的空气,氨气与水接触,即发生喷泉。②直接用冰块冷却圆底烧瓶 A
【解析】试题分析:(1)图Ⅰ装置适合固体和液体不加热制取氨气;(2)根据氨气的密度比空气小,且易溶于水的性质选择收集氨气的方法,根据氨气是碱性气体选择干燥剂;(3)![]() 极易溶于水,打开止水夹,挤出胶头滴管中的水,致辞使烧瓶内气体压强迅速减小,外界大气压将烧杯中水压入烧瓶,形成喷泉;
极易溶于水,打开止水夹,挤出胶头滴管中的水,致辞使烧瓶内气体压强迅速减小,外界大气压将烧杯中水压入烧瓶,形成喷泉;
(4)用手(或热毛巾)捂热烧瓶,氨气受热膨胀,赶出玻璃导管内的空气,氨气与水接触,即发生喷泉;(5)根据![]() 计算。
计算。
解析:(1)图Ⅰ装置适合固体和液体不加热制取氨气,所以最合适的试剂是浓氨水、CaO(s);(2)氨气的密度比空气小,且易溶于水,所以收集氨气的方法是向下排空气法,氨气是碱性气体,用碱石灰干燥氨气;
(3)用图Ⅱ装置进行喷泉实验,引发水上喷的操作是打开止水夹,挤出胶头滴管中的水,该实验的原理是![]() 极易溶于水,致辞使烧瓶内气体压强迅速减小,外界大气压将烧杯中水压入烧瓶,形成喷泉;
极易溶于水,致辞使烧瓶内气体压强迅速减小,外界大气压将烧杯中水压入烧瓶,形成喷泉;
(4)图Ⅲ的装置,引发喷泉的方法是用手(或热毛巾)捂热烧瓶,氨气受热膨胀,赶出玻璃导管内的空气,氨气与水接触,即发生喷泉;(5)①设烧瓶的容积是VL,则氨气的物质的量是![]() ,由于氨气极易溶于水,所以水充满烧瓶,则烧瓶内的氨水的物质的量浓度是
,由于氨气极易溶于水,所以水充满烧瓶,则烧瓶内的氨水的物质的量浓度是![]() ;②设烧瓶的容积是VL,则氨气的物质的量是
;②设烧瓶的容积是VL,则氨气的物质的量是![]() ,由于氨气极易溶于水,所以水充满烧瓶体积的
,由于氨气极易溶于水,所以水充满烧瓶体积的![]() ,则烧瓶内的氨水的物质的量浓度是
,则烧瓶内的氨水的物质的量浓度是![]() ;③设烧瓶的容积是VL,则NO2的物质的量是
;③设烧瓶的容积是VL,则NO2的物质的量是![]() ,根据
,根据![]() , NO2与水反应生成硝酸的物质的量是
, NO2与水反应生成硝酸的物质的量是![]() ,水充满烧瓶的
,水充满烧瓶的![]() ,则烧瓶内的硝酸物质的量浓度是
,则烧瓶内的硝酸物质的量浓度是![]() ,所以①=②=③,故A正确。
,所以①=②=③,故A正确。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】钛的化合物如TiO2、Ti(NO3)4、TiCl4、 Ti(BH4)2等均有着广泛用途。
(1)写出Ti的基态原子的外围电子排布式____________。
(2)TiCl4熔点是-25℃,沸点136.4℃,可溶于苯或CCl4,该晶体属于_____晶体;BH4-中B原子的杂化类型为____________;
(3)在 TiO2催化作用下,可将CN-氧化成CNO-,进而得到N2。与CNO-互为等电子体的分子化学式为_________________。
(4)Ti3+可以形成两种不同的配合物:[Ti(H2O)6]Cl3(紫色),[TiCl(H2O)5]Cl2H2O(绿色),两者配位数_____(填“相同”或“不同”),绿色晶体中配体是______。

(5)TiO2难溶于水和稀酸,但能溶于浓硫酸,析出含有钛酰离子的晶体,钛酰离子常成为链状聚合形式的阳离子,其结构形式如图1,化学式为____________。
(6)金属钛内部原子的堆积方式是面心立方堆积方式,如图2。若该晶胞的密度为![]() g/cm3,阿伏加德罗常数为NA,则该晶胞的边长为______________cm。
g/cm3,阿伏加德罗常数为NA,则该晶胞的边长为______________cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不锈钢以其优异的抗腐蚀性能越来越受到人们的靑睐,它主要是由铁、铬、镍、铜、碳等元索所组成的合金。请完成以下有关物质结构的问题:
(1)写出Fe2+的最高能层的电子排布式:________________。
(2)[Cr(H2O)4Cl2] Cl·2H2O中Cr 的配位数为________________;
已知CrO5中Cr为+6价,则CrO5的结构式为________。
(3)金属镍粉在CO气流中轻微加热,生成无色挥发性液体Ni(CO)n,推测Ni(CO)n的晶体类型为_______;己知该物质的中心原子价电子数与配体提供电子总数之和为18,则n=__________;与Ni(CO)n中配体互为等电子体的阴离子化学式为________________。
(4)金刚砂(SiC)结构与金刚石结构相似,若将金刚石晶体中一半的C原子换成Si原子且同种原子不成键,则得到金刚砂(SiC)结构。SiC是_________晶体,键角是_________;在SiC中,如果以一个硅原子为中心,则与硅原子次近的第二层有________个硅原子。
(5)铜是第四周期最重要的过渡元素之一,其单质及化合物具有广泛用途。CuH的晶体结构如下图所示,若CuH的密度为d g ·cm-3,阿伏加德罗常数的值为NA,则该晶胞的边长为______cm(用含d和Na的式子表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列说法正确的是
A. AgCl固体在等物质的量浓度的NaCl、MgCl2溶液中的溶度积相同
B. 在0.1mol/L的NaOH溶液中,由水电离出的c(H+)>![]()
C. 将NH4Cl溶液从20 ℃升温至30 ℃,溶液中![]() 增大
增大
D. CH3COONa和盐酸两溶液混合后,呈中性的混合溶液中:c(Na+)=c(Cl-)>c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求写化学方程式:
(1)一种单质还原一种化合物_____________________________________
(2)一种单质氧化另一种单质_________________________________________
(3)一种非金属单质还原一种氧化物________________________________________
(4)同一物质中一种元素氧化另一种元素______________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,A、B、C、D、E各代表水、铁、二氧化碳、硫酸铜溶液、氢氧化钡溶液中的一种物质。常温下,相连环物质间能发生反应,不相连环物质间不能发生反应,且B的相对分子质量大于D。请填空:

(1)写出下列物质的化学式:A_______,B_______,D_______。
(2)写出下列反应的化学方程式:B+C:________________________________________,
(3)相连环物质间发生的反应中,置换反应共有____________个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年华北地区频繁的雾霾天气已经引起人们的高度重视,化学反应原理可用于治理环境污染,请回答下列问题:
(1)一定条件下,可以用CO处理燃煤烟气生成液态硫,实现硫的回收。
①已知:2CO(g)+O2(g) = 2CO2(g) ΔH= -566 kJ·mol-1
S(l) +O2(g) = SO2(g) ΔH=-296 kJ·mol-1
则用CO处理燃煤烟气的热化学方程式是_____________________。
②在一定温度下,在2 L密闭容器中投入2 mol CO、l mol SO2发生上述反应,达到化学平衡时SO2的转化率为90%,则该温度下该反应的平衡常数K的数值为____________。
(2)SNCR—SCR是一种新型的烟气脱硝技术(除去烟气中的NOx),其流程如下:
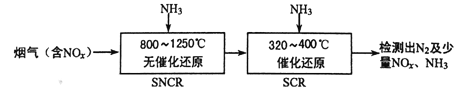
已知该方法中主要反应的热化学方程式:4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g) ΔH=-1646 kJ·mol-1,在一定温度下,在密闭恒压的容器中,能表示上述反应达到化学平衡状态的是__________________(填字母)。
4N2(g)+6H2O(g) ΔH=-1646 kJ·mol-1,在一定温度下,在密闭恒压的容器中,能表示上述反应达到化学平衡状态的是__________________(填字母)。
a. 4v逆(N2) = v正(O2)
b.混合气体的密度保持不变
c. c(N2)∶c(H2O)∶c(NH3)=4∶6∶4
d.单位时间内断裂4 mol N-H键的同时断裂4 mol![]() 键
键
(3)如图所示,反应温度会直接影响SNCR技术的脱硝效率。
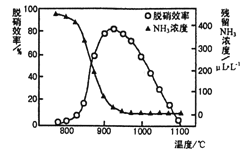
①SNCR技术脱硝的最佳温度选择925 ℃的理由是_____________。
②SNCR与SCR技术相比,SNCR技术的反应温度较高,其原因是________________;但当烟气温度高于1000℃时,SNCR脱硝效率明显降低,其原因可能是__________________。
(4)一种三室微生物燃料电池可用于污水净化、海水淡化,其工作原理如图所示:
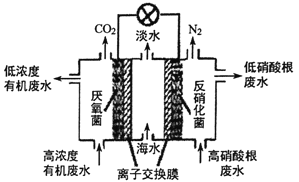
①中间室的Cl-移向_________(填“左室”或“右室”),处理后的含硝酸根废水的pH__________(填“降低”或“升高”)
②若图中有机废水中有机物用C6H12O6表示, 请写出左室发生反应的电极反应式:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将盛有12mLNO2和O2的混合气体的量筒倒立于水槽中,充分反应后,还剩余2mL气体,则原混合气体中O2的体积是
A. 2mL B. 2.4mL C. 3.6mL D. 4mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)6.02×1023个氢氧根离子的物质的量是________mol,其摩尔质量为________。
(2)3.01×1023个H2O的物质的量为________mol,其中,所有原子的物质的量为________mol,所含电子的物质的量为________mol。
(3)1.204×1023个![]() 的物质的量为________mol,质量为________g。
的物质的量为________mol,质量为________g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com