
【题目】钛的化合物如TiO2、Ti(NO3)4、TiCl4、 Ti(BH4)2等均有着广泛用途。
(1)写出Ti的基态原子的外围电子排布式____________。
(2)TiCl4熔点是-25℃,沸点136.4℃,可溶于苯或CCl4,该晶体属于_____晶体;BH4-中B原子的杂化类型为____________;
(3)在 TiO2催化作用下,可将CN-氧化成CNO-,进而得到N2。与CNO-互为等电子体的分子化学式为_________________。
(4)Ti3+可以形成两种不同的配合物:[Ti(H2O)6]Cl3(紫色),[TiCl(H2O)5]Cl2H2O(绿色),两者配位数_____(填“相同”或“不同”),绿色晶体中配体是______。

(5)TiO2难溶于水和稀酸,但能溶于浓硫酸,析出含有钛酰离子的晶体,钛酰离子常成为链状聚合形式的阳离子,其结构形式如图1,化学式为____________。
(6)金属钛内部原子的堆积方式是面心立方堆积方式,如图2。若该晶胞的密度为![]() g/cm3,阿伏加德罗常数为NA,则该晶胞的边长为______________cm。
g/cm3,阿伏加德罗常数为NA,则该晶胞的边长为______________cm。
【答案】3d24s2分子晶体sp3CO2(或N2O、CS2、BeCl2等合理均可给分,写成离子的不得分)相同Cl﹣、H2O[TiO]n2n+![]()
【解析】(1)钛是22号元素,根据构造原理知其基态核外电子排布式为1s22s22p63s23p63d24s2,则其基态原子的外围电子排布式为3d24s2 ;
(2)因TiCl4在常温下是无色液体,熔点-23.2℃,沸点136.2℃,熔沸点低,由此可判断 TiCl4是由共价键结合的分子,晶体类型属于分子晶体,BH4-中B原子价层电子对=4+![]() (3+1-4×1)=4,且没有孤电子对,则BH4-中B原子的杂化类型为sp3;
(3+1-4×1)=4,且没有孤电子对,则BH4-中B原子的杂化类型为sp3;
(3)CNO-中含有3个原子,16个价电子,所以其等电子体中分子为:CO2(或N2O、CS2、BeCl2等),离子为:SCN-或(N3-)等;
(4)[Ti( H2O)6]Cl3(紫色),配体为:H2O,配位数为6,[TiCl(H2O)5]Cl2H2O(绿色),配体为Cl-、H2O,配位数为6,两者配位数相同;
(5)每个O原子被两个Ti原子共用、每个Ti原子被两个O原子共用,利用均摊法计算二者原子个数之比为1:1;Ti元素为+4价、O元素为-2价,据此书写其化学式为[TiO]n2n+;
(6)在每个钛的晶胞中含有钛原子数为8×![]() +6×
+6×![]() =4,设晶胞的连长为a,根据ρ=
=4,设晶胞的连长为a,根据ρ=![]() 有,ρ=
有,ρ=![]() ,所以a=
,所以a=![]() cm=
cm=![]() cm。
cm。


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数约为6.02×1023/mol,下列说法一定正确的是
A. 60gSiO2晶体中,约含有2×6.02×1023个Si-O键
B. 78gNa2O2晶体中约有2×6.02×1023个阴离子
C. 720g C60晶体约含有6.02×1023个如图中晶胞单元

D. 14g两种烯烃CnH2n和CmH2m混合物,含有共用电子对数目约为3×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图甲和图乙表示的是元素的某种性质随原子序数的变化。下列说法正确的是
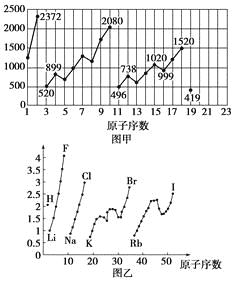
A. 图甲可能表示的是元素原子的第一电离能随原子序数的变化关系
B. 图甲可能表示的是元素单质的熔点随原子序数的变化关系
C. 图乙可能表示的是元素原子的半径随原子序数的变化关系
D. 图乙不可能表示同族元素的电负性随原子序数的变化关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的Cl2和SO2通入BaCl2溶液,充分反应后滴入品红溶液,能观察到的现象是:①出现沉淀;②不出现沉淀;③品红溶液褪色;④品红溶液不褪色
A. ①④ B. ①③ C. ①② D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2·6H2O的工艺流程如下:
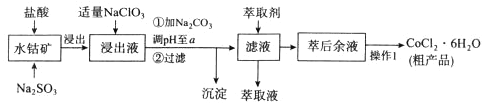
已知:①浸出液含有的阳离子主要有H+、CO2+、Fe2+、Mn2+、Al3+等;
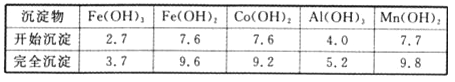
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表(金属离子浓度为0.01 mol/L):
③CoCI2.6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
(1)写出浸出过程中Co2O3发生反应的离子方程式: 。
(2)写出NaClO3发生反应的主要离子方程式: ;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式: 。
(3)惰性电极电解CoCl2溶液的阳极电极反应式为 。
(4)“操作1”中包含3个基本实验操作,它们依次是 、 和过滤。制得的CoCl2·6H2O在烘干时需减压烘干的原因是 。
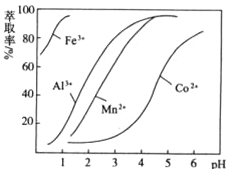
(5)萃取剂对金属离子的萃取率与pH的关系如图向“滤液”中加入萃取剂的目的是 ,其使用的最佳pH范围是 。
A.2.0~2.5 | B.3.0~3.5 |
C.4.0~4.5 | D.5.0~5.5 |
(6)力测定粗产品中CoCl2·H2O的含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是 。(答一条即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用如图所示实验装置测定常温常压下的气体摩尔体积。
根据下列步骤完成实验:
①装配好装置,检查气密性
②用砂纸擦去镁带表面的氧化物,然后取0.0480g的镁带加入仪器a中,分液漏斗内加入足量1mol/L硫酸溶液
③量气装置中加入适量水,记录量气管读数(读数为0.10mL)
④通过分液漏斗向仪器a中加入适量硫酸溶液,使镁带与硫酸充分反应
⑤当镁带完全反应后,再次记录量气管读数(读数为49.60mL)。

完成下列填空:
(1)仪器a的名称_______,通过分液漏斗向仪器a中加入硫酸溶液的操作是_______。
(2)在记录量气管读数时,应注意将_______,再________,视线与量气管内凹液面相切,水平读数。
(3)该同学测出此条件下气体摩尔体积为__________,测定结果比理论值偏大,可能的原因是(填字母代号)__________。
a.镁带中氧化膜未除尽 b.镁带含有杂质铝
c.③记录量气管读数时俯视读数 d.镁带完全反应后有残留的未溶固体
(4)与原方案装置相比,有同学设想用装置B代替装置A,实验精确度更高。请说明理由____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素R的最高价氧化物的水化物分子式是HnRO2n-2,则在气态氢化物的化学式是( )
A. H3n-10R B. H12-3n R C. H3n-4R D. H3n-12R
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室要制取氨气并完成喷泉实验。

(1)实验室选用图Ⅰ装置来制取氨气,试剂有:①NH4Cl(s) ②Ca(OH)2(s) ③NH4NO3(s) ④浓氨水 ⑤氢氧化钠溶液 ⑥CaO(s)。最合适的试剂是(填编号)___________。
(2)收集氨气应使用________法,要得到干燥的氨气可选用__________作干燥剂。
(3)用图Ⅱ装置进行喷泉实验,上部烧瓶已装满氨气,引发水上喷的操作是________________________,该实验的原理是___________________。
(4)如果只提供如图Ⅲ的装置,请说明引发喷泉的方法:_______________________。
(5)如图Ⅱ的装置有3个,烧瓶中分别盛有:①纯氨气、②含有1/10空气的氨气、③纯二氧化氮,在同温下分别进行喷泉实验,理论上得到的溶液物质的量浓度为(____)
A.①=②=③ B.①>②>③ C.①>③>② D.②>①>③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com