
【题目】图甲和图乙表示的是元素的某种性质随原子序数的变化。下列说法正确的是
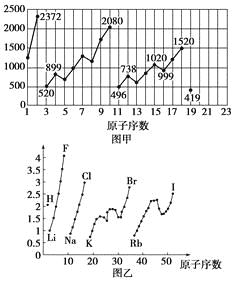
A. 图甲可能表示的是元素原子的第一电离能随原子序数的变化关系
B. 图甲可能表示的是元素单质的熔点随原子序数的变化关系
C. 图乙可能表示的是元素原子的半径随原子序数的变化关系
D. 图乙不可能表示同族元素的电负性随原子序数的变化关系
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:
【题目】实验是化学研究的基础,下列实验设计原理正确的是

A. 装置①:可用于吸收NH3,并防止倒吸
B. 装置②:验证溴乙烷发生消去反应生成烯烃
C. 装置③:观察原电池装置中电流表指针偏转
D. 装置④:由实验现象推知酸性强弱顺序为CH3COOH>H2CO3>C6H5OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体混合物,由NaOH、AlCl3、MgCl2组成,将它放入足量的水中,充分搅拌后,有0.58g白色沉淀,在所得到的浊液中逐滴加入0.5mol/L的盐酸,加入盐酸的体积与生成沉淀的质量(g)关系如图所示。(假定:加入NaOH溶液后,Al3+、Mg2+转化为沉淀不存在先后顺序)

(1)沉淀的最大值,即m= ___________________g。
(2)沉淀完全溶解时,所消耗盐酸的体积a=________________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元索X、Y、Z、W、R原子序数依次增大,X原子最外层电子数是其内层电子数的2倍,Y、R同主族,且两者核外电子数之和是x核外电子数的4倍,Z是迄今发现的非金属性最强的元素,在周期表中W位于ⅠA族。
请按要求回答:
(1)元素X在周期表中所处位置为________。
(2)元素Y、R的简单氢化物稳定性由强到弱的顺序为________(写氢化物的化学式)。
(3)元素Z、W的简单离子半径由大到小的顺序依次为________(填离子符号)。
(4)W、R两种元素最高价氧化物对应的水化物在水溶液中相互反应的离子方程式为____________。
(5)已知:在加热条件下,R单质能与W的氢氧化物水溶液反应,产物中R元素的分别为+4和-2。试写出该反应的化学方程式:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列流程中有机物均为芳香族化合物。H为一种酯,其合成路线如下:

已知以下信息:
① 有机物B能发生银镜反应,D的相对分子质量比C大4,E的苯环上的一溴代物有两种。
②![]()
③![]()
请回答下列问题:
(1)A的结构简式____________ ,C→D的反应类型为_____________;B中含氧官能团名称为__________ ,F中不含氧的官能团的名称为___________ ; H的结构简式为___________;
(2)E→F与F→G的顺序不能颠倒,理由是___________;
(3)F→G ①的化学方程式为___________;
(4)G还可以通过缩聚反应制得高分子材料,试写出其结构简式___________;
(5)A的同分异构体很多,其中能使FeCl3溶液显紫色有___________种,写出一种核磁共振氢谱有4组峰的分子的结构简式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是
A. 碳单质有同素异形体,氧单质没有
B. 在氧化还原反应中,非金属单质一定是氧化剂
C. 某元素从化合态变为游离态时,该元素一定被还原
D. 可以用萃取的方法将溴单质或碘单质从它们的水溶液中提取出来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】促进生态文明,保护生态环境,是实现“中国梦”的重要组成部分。
(1)天然水中杂质较多,常需加入明矾、漂白粉等物质处理后才能饮用。加入明矾的作用是________;漂白粉能杀菌消毒是因为漂白粉使蛋白质发生________。
(2)处理废水中重金属铊(TI),需在废水中加入NaClO,作________(填“氧化剂”或“还原剂”),将TI+转变为TI3+;再加入氨水,将TI3+转变为难溶物TI(OH)3,写出生成TI(OH)3,的离子方程式:________。该方法处理后的废水中因含有大量的________元素(填写元素名称),直接排放易导致水体富营养化。
(3)聚乙烯塑料常用于食品包装,随便丢弃会造成白色污染。聚乙烯的结构简式是________,聚乙烯塑料属于________(填“热固性”或“热塑性”)塑料。
(4)空气污染指数是根据空气中________、二氧化氮和可吸入颗粒等污染物的浓度计算出来的数值。大气污染的危害是多方面的,如形成酸雨,除雨是指pH小于________的降水。
(5)用氧缺位铁酸铜(CuFe2O4-x)作催化剂,利用太阳能热化学循环分解H2O可制H2,其物质转化如图所示。写出其中氧缺位铁酸铜(CuFe2O4-x)与水反应的化学方程式:________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛的化合物如TiO2、Ti(NO3)4、TiCl4、 Ti(BH4)2等均有着广泛用途。
(1)写出Ti的基态原子的外围电子排布式____________。
(2)TiCl4熔点是-25℃,沸点136.4℃,可溶于苯或CCl4,该晶体属于_____晶体;BH4-中B原子的杂化类型为____________;
(3)在 TiO2催化作用下,可将CN-氧化成CNO-,进而得到N2。与CNO-互为等电子体的分子化学式为_________________。
(4)Ti3+可以形成两种不同的配合物:[Ti(H2O)6]Cl3(紫色),[TiCl(H2O)5]Cl2H2O(绿色),两者配位数_____(填“相同”或“不同”),绿色晶体中配体是______。

(5)TiO2难溶于水和稀酸,但能溶于浓硫酸,析出含有钛酰离子的晶体,钛酰离子常成为链状聚合形式的阳离子,其结构形式如图1,化学式为____________。
(6)金属钛内部原子的堆积方式是面心立方堆积方式,如图2。若该晶胞的密度为![]() g/cm3,阿伏加德罗常数为NA,则该晶胞的边长为______________cm。
g/cm3,阿伏加德罗常数为NA,则该晶胞的边长为______________cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不锈钢以其优异的抗腐蚀性能越来越受到人们的靑睐,它主要是由铁、铬、镍、铜、碳等元索所组成的合金。请完成以下有关物质结构的问题:
(1)写出Fe2+的最高能层的电子排布式:________________。
(2)[Cr(H2O)4Cl2] Cl·2H2O中Cr 的配位数为________________;
已知CrO5中Cr为+6价,则CrO5的结构式为________。
(3)金属镍粉在CO气流中轻微加热,生成无色挥发性液体Ni(CO)n,推测Ni(CO)n的晶体类型为_______;己知该物质的中心原子价电子数与配体提供电子总数之和为18,则n=__________;与Ni(CO)n中配体互为等电子体的阴离子化学式为________________。
(4)金刚砂(SiC)结构与金刚石结构相似,若将金刚石晶体中一半的C原子换成Si原子且同种原子不成键,则得到金刚砂(SiC)结构。SiC是_________晶体,键角是_________;在SiC中,如果以一个硅原子为中心,则与硅原子次近的第二层有________个硅原子。
(5)铜是第四周期最重要的过渡元素之一,其单质及化合物具有广泛用途。CuH的晶体结构如下图所示,若CuH的密度为d g ·cm-3,阿伏加德罗常数的值为NA,则该晶胞的边长为______cm(用含d和Na的式子表示)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com