
【题目】某固体混合物,由NaOH、AlCl3、MgCl2组成,将它放入足量的水中,充分搅拌后,有0.58g白色沉淀,在所得到的浊液中逐滴加入0.5mol/L的盐酸,加入盐酸的体积与生成沉淀的质量(g)关系如图所示。(假定:加入NaOH溶液后,Al3+、Mg2+转化为沉淀不存在先后顺序)

(1)沉淀的最大值,即m= ___________________g。
(2)沉淀完全溶解时,所消耗盐酸的体积a=________________mL。
【答案】 1.36g 130mL
【解析】向所得浊液中,逐滴加入0.5mol/L盐酸,由加入盐酸的体积和生成沉淀的质量关系图分析:
①0-10mL,随盐酸的体积增加,生成沉淀的质量不变,说明沉淀是Mg(OH)2,m[Mg(OH)2]=0.58g,NaOH、AlCl3、MgCl2组成的混合物,溶于足量水发生反应是:MgCl2+2NaOH=Mg(OH)2↓+2NaCl;AlCl3+4NaOH=NaAlO2+3NaCl+2H2O,NaOH有剩余,溶液是NaCl、NaAlO2和NaOH的混合液,该阶段发生反应是:NaOH+HCl=NaCl+H2O;
②10mL处,加入10ml盐酸刚好中和未反应的NaOH,溶液为NaCl、NaAlO2;
③10mL-30ml,随盐酸的体积增加,生成沉淀的质量增加,该阶段发生反应是:NaAlO2+HCl+H2O=Al(OH)3↓+NaCl;
④30mL处,NaAlO2与盐酸恰好反应,需盐酸体积为:30ml-10ml=20ml,沉淀质量达到最大,溶液为NaCl溶液;
⑤30mL-a点,随盐酸的体积增加,沉淀的质量减少,发生反应是:Mg(OH)2+2HCl=MgCl2+2H2O;
Al(OH)3+3 HCl=AlCl3+3H2O;
⑥a点,Mg(OH)2和Al(OH)3完全反应,溶液为MgCl2、AlCl3和NaCl混合液;
(1)10mL-30ml,随盐酸的体积增加,生成沉淀的质量增加,该阶段发生反应是:NaAlO2+HCl+H2O=Al(OH)3↓+NaCl;
生成的Al(OH)3的物质的量为0.02L×0.5mol/L=0.01mol,质量为0.01mol×78g/mol=0.78g,
则沉淀的最大量为:0.58g+0.78g=1.36g。
(2)选30mL处,计算NaOH的质量,此时溶液为NaCl溶液,溶液中Cl-来源于原混合物中的AlCl3、MgCl2和加入的30mlHCl,溶液中Na+来源于原混合物中的NaOH,
NaAlO2+HCl+H2O=Al(OH)3↓+NaCl
0.01mol0.02L×0.5mol/L=0.01mol
由Al原子守恒得原混合物中n(AlCl3)=n(NaAlO2)=0.01mol
由Mg原子守恒得原混合物中n(MgCl2)=n[Mg(OH)2]= ![]() =0.01mol,
=0.01mol,
由Na+离子和Cl-离子守恒得:n(NaOH)=n(NaCl)=n(Cl-)=2n(MgCl2)+3n(AlCl3)+n(HCl)=0.01mol×2+0.01mol×3+0.03L×0.5mol/L=0.065mol;
沉淀完全溶解后溶液为MgCl2、AlCl3和NaCl混合液,a点所加盐酸相等于用于中和原混合物中的NaOH,
此时所加盐酸物质的量:n(HCl)=n(NaOH)=0.065mol,
P点所表示盐酸的体积为:V=![]() =0.13L=130mL。
=0.13L=130mL。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是( )

A. 反应开始到10s,用Z表示的反应速率为0.158mol/(Ls)
B. 反应开始到10s, X的物质的量浓度减少了0.79mol/L
C. 反应开始到10s, Y的转化率为79.0%
D. 反应的化学方程式为:X(g)+Y(g)![]() Z(g)
Z(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D分别是NaNO3、NaOH、HNO3和Ba(NO3)2四种溶液中的一种,现利用另一种溶液X,用如图所示的方法可将它们依次确定。

试确定A、B、C、D、X各代表何种溶液。
A:________,B:__________,C:_________,D:_________,X:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数约为6.02×1023/mol,下列说法一定正确的是
A. 60gSiO2晶体中,约含有2×6.02×1023个Si-O键
B. 78gNa2O2晶体中约有2×6.02×1023个阴离子
C. 720g C60晶体约含有6.02×1023个如图中晶胞单元

D. 14g两种烯烃CnH2n和CmH2m混合物,含有共用电子对数目约为3×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列生活中常见物质的俗名与化学式相对应的是( )
A. 生石灰—Ca(OH)2 B. 重晶石—BaCO3
C. 明矾—CuSO4·5H2O D. 小苏打—NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼及其化合物应用广泛。回答下列问题:
(1)基态B原子的价电子轨道表达式为________,其第一电离能比Be ________(填“大”或“小”)。
(2)氨硼烷(NH3BH3)被认为是最具潜力的新型储氢材料之一,分子中存在配位键,提供孤电子对的成键原子是________,写出一种与氨硼烷互为等电子体的分子________(填化学式)。

(3)常温常压下硼酸(H3BO3)晶体结构为层状,其二维平面结构如图a。
① B原子的杂化方式为________。从氢键的角度解释硼酸在冷水中的溶解度小而加热时溶解度增大:________。
② 路易斯酸碱理论认为,任何可接受电子对的分子或离子叫路易斯酸,任何可给出电子对的分子或离子叫路易斯碱。从结构角度分析硼酸是路易斯酸:________。
(4)立方氮化硼(BN)是特殊的耐磨和切削材料,其晶胞结构与金刚石相似,如图b所示。
① 与氮原子直接连接的硼原子构成的几何形状为________。硼原子和氮原子所连接的最小环为________元环。
② 晶胞有两个基本要素:
原子坐标参数,表示晶胞内部各原子的相对位置。如图b所示,其中原子坐标参数X为(0,0,0),Y原子的坐标参数为(1/2,0,1/2),则Z原子的坐标参数为________。
晶胞参数,描述晶胞的大小和形状。已知立方氮化硼的密度为d gcm-3,阿伏加德罗常数值为NA,则晶胞参数a=________nm。(列出计算式即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴乙烷是一种难溶于水、密度约为水的密度的1.5倍、沸点为38.4℃的无色液体。如图为实绘室制备溴乙烷的装置示意图(夹持仅器已略去)。G中盛蒸馏水,实验时选用的药品有:溴化钠、95%乙醇、浓H2SO4。边反应边蒸馏,蒸出的溴乙烷用水下收集法获得。实验室制备溴乙烷的反应原理如下
NaBr+H2SO4(浓)![]() NaHSO4+HBr CH3CH2OH+HBr→CH3CH2Br+H2O
NaHSO4+HBr CH3CH2OH+HBr→CH3CH2Br+H2O
己知药品的用量:①NaBr(s)0.3mol,②浓硫酸36mL(98%、密度1.84g/cm3),③乙醇0.25mol。
可能存在的副反应有:醇在浓硫酸存在下脱水生成烯和醚,Br-被浓硫酸氧化为Br2等。试问答:
(1)为防止副反应的发生,向圆底烧瓶内加入药品时,还需加入适量的______。
(2)装置B的作用是:①使溴乙烷馏出,②_________。
(3)溴乙烷可用水下收集法的依据是______、_______。
(4)粗产品用水洗涤后有机层仍呈红棕色,欲除去该杂质,可加入的试剂为____(填编号)。
a.碘化钾溶液b.亚硫酸氢钠溶液c.氢氧化钠溶液
(5)本实验的产率为60%,则可制取溴乙烷______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图甲和图乙表示的是元素的某种性质随原子序数的变化。下列说法正确的是
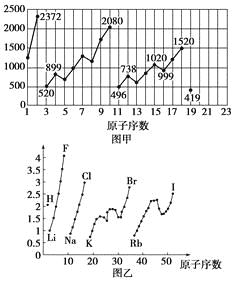
A. 图甲可能表示的是元素原子的第一电离能随原子序数的变化关系
B. 图甲可能表示的是元素单质的熔点随原子序数的变化关系
C. 图乙可能表示的是元素原子的半径随原子序数的变化关系
D. 图乙不可能表示同族元素的电负性随原子序数的变化关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素R的最高价氧化物的水化物分子式是HnRO2n-2,则在气态氢化物的化学式是( )
A. H3n-10R B. H12-3n R C. H3n-4R D. H3n-12R
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com