
【题目】下列流程中有机物均为芳香族化合物。H为一种酯,其合成路线如下:

已知以下信息:
① 有机物B能发生银镜反应,D的相对分子质量比C大4,E的苯环上的一溴代物有两种。
②![]()
③![]()
请回答下列问题:
(1)A的结构简式____________ ,C→D的反应类型为_____________;B中含氧官能团名称为__________ ,F中不含氧的官能团的名称为___________ ; H的结构简式为___________;
(2)E→F与F→G的顺序不能颠倒,理由是___________;
(3)F→G ①的化学方程式为___________;
(4)G还可以通过缩聚反应制得高分子材料,试写出其结构简式___________;
(5)A的同分异构体很多,其中能使FeCl3溶液显紫色有___________种,写出一种核磁共振氢谱有4组峰的分子的结构简式___________。
【答案】 ![]() 加成反应 醛基 氯原子
加成反应 醛基 氯原子 ![]() 如果颠倒则(酚)羟基会被KMnO4/H+氧化
如果颠倒则(酚)羟基会被KMnO4/H+氧化 ![]()
 9
9 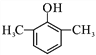 或
或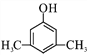
【解析】A-I均为芳香族化合物,根据A的分子式可知A的侧链为饱和结构,A能够催化氧化生成B,B能够发生银镜反应,且能够发生信息③中反应,则B分子中含有苯环和侧链-CH2CHO结构,故B的结构简式为![]() ,A为
,A为![]() ,则C为
,则C为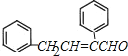 ,D比C的相对分子质量大4,恰好为2分子氢气,则说明C与氢气发生加成反应生成D,故D为
,D比C的相对分子质量大4,恰好为2分子氢气,则说明C与氢气发生加成反应生成D,故D为 ;E的苯环上的一溴代物有两种,E能够被酸性高锰酸钾溶液氧化,E中含有甲基,则E为
;E的苯环上的一溴代物有两种,E能够被酸性高锰酸钾溶液氧化,E中含有甲基,则E为![]() ;E被酸性高锰酸钾溶液氧化成F,则F为
;E被酸性高锰酸钾溶液氧化成F,则F为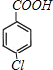 ;F在浓NaOH溶液中加热发生水解反应生成酚羟基和羧酸钠,然后在酸性条件下转化成G,则G为
;F在浓NaOH溶液中加热发生水解反应生成酚羟基和羧酸钠,然后在酸性条件下转化成G,则G为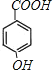 ,G和D发生酯化反应生成H,则H为
,G和D发生酯化反应生成H,则H为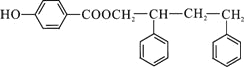 。
。
(1)A的结构简式为![]() ,C发生加成反应生成D,B的结构简式为
,C发生加成反应生成D,B的结构简式为![]() ,其中含氧官能团为醛基;F为
,其中含氧官能团为醛基;F为 ,F中不含氧官能团名称是氯原子,H的结构简式为
,F中不含氧官能团名称是氯原子,H的结构简式为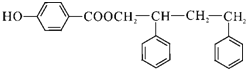 ,故答案为:
,故答案为:![]() ;加成反应;醛基;氯原子;
;加成反应;醛基;氯原子; ;
;
(2)如果颠倒,则(酚)羟基会被KMnO4/H+氧化,所以二者不能颠倒,故答案为:如果颠倒则(酚)羟基会被KMnO4/H+氧化;
(3)F→G①的化学方程式为![]() ,故答案为:
,故答案为:
![]() ;
;
(4)G为 ,G中含有羧基和酚羟基,所以能发生缩聚反应生成高分子化合物,该高分子化合物结构简式为
,G中含有羧基和酚羟基,所以能发生缩聚反应生成高分子化合物,该高分子化合物结构简式为![]() ,故答案为:
,故答案为:![]() ;
;
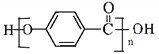
(5)A为![]() ,A的同分异构体能和氯化铁溶液发生显色反应,说明A的同分异构体中含有酚羟基,如果取代基含有-OH和-CH2CH3,有邻间对3种同分异构体;如果取代基含有-OH和两个-CH3,如果两个甲基位于相邻位置,有2种同分异构体;如果两个甲基位于相间位置,有3种同分异构体;如果两个甲基位于相对位置,有1种同分异构体,所以符合条件的一共有9种,核磁共振氢谱有4组峰的分子的结构简式为
,A的同分异构体能和氯化铁溶液发生显色反应,说明A的同分异构体中含有酚羟基,如果取代基含有-OH和-CH2CH3,有邻间对3种同分异构体;如果取代基含有-OH和两个-CH3,如果两个甲基位于相邻位置,有2种同分异构体;如果两个甲基位于相间位置,有3种同分异构体;如果两个甲基位于相对位置,有1种同分异构体,所以符合条件的一共有9种,核磁共振氢谱有4组峰的分子的结构简式为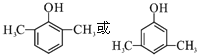 ,故答案为:9;
,故答案为:9; 。
。


科目:高中化学 来源: 题型:
【题目】某制药厂利用C2H4、水杨酸以及C4H8合成一种药物K,其合成路线设计如下:
| |
D能与NaHCO3溶液作用生成气体,遇FeCl3溶液不显紫色;G无酸性,H、I有酸性。
(1)上述过程中属于取代反应的是_____________________;
(2)C结构中官能团的电子式为_______________,E的结构简式为__________________________;
(3)反应⑦的化学方程式为______________________________________________;
(4)D与足量NaOH溶液共热的化学方程式为_________________________________________________________;
(5)I的属于链状酯类化合物的同分异构体共有_________种(不考虑立体异构)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列生活中常见物质的俗名与化学式相对应的是( )
A. 生石灰—Ca(OH)2 B. 重晶石—BaCO3
C. 明矾—CuSO4·5H2O D. 小苏打—NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴乙烷是一种难溶于水、密度约为水的密度的1.5倍、沸点为38.4℃的无色液体。如图为实绘室制备溴乙烷的装置示意图(夹持仅器已略去)。G中盛蒸馏水,实验时选用的药品有:溴化钠、95%乙醇、浓H2SO4。边反应边蒸馏,蒸出的溴乙烷用水下收集法获得。实验室制备溴乙烷的反应原理如下
NaBr+H2SO4(浓)![]() NaHSO4+HBr CH3CH2OH+HBr→CH3CH2Br+H2O
NaHSO4+HBr CH3CH2OH+HBr→CH3CH2Br+H2O
己知药品的用量:①NaBr(s)0.3mol,②浓硫酸36mL(98%、密度1.84g/cm3),③乙醇0.25mol。
可能存在的副反应有:醇在浓硫酸存在下脱水生成烯和醚,Br-被浓硫酸氧化为Br2等。试问答:
(1)为防止副反应的发生,向圆底烧瓶内加入药品时,还需加入适量的______。
(2)装置B的作用是:①使溴乙烷馏出,②_________。
(3)溴乙烷可用水下收集法的依据是______、_______。
(4)粗产品用水洗涤后有机层仍呈红棕色,欲除去该杂质,可加入的试剂为____(填编号)。
a.碘化钾溶液b.亚硫酸氢钠溶液c.氢氧化钠溶液
(5)本实验的产率为60%,则可制取溴乙烷______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氧化二镍(Ni2O3)是一种灰黑色无气味有光泽的块状物,易碎成细粉末,常用于制造高能电池。工业上以金属镍废料生产NiCl2,继而生产Ni2O3的工艺流程如下:

下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
开始沉淀的pH | 1.1 | 6.5 | 3.5 | 7.1 |
沉淀完全的pH | 3.2 | 9.7 | 4.7 | 9.2 |
(1)为了提高金属镍废料浸出的速率,在“酸浸”时可采取的措施有:①适当升高温度;②搅拌;③___________等。
(2)酸浸后的酸性溶液中含有Ni2+、Cl-,另含有少量Fe2+、Fe3+、Al3+等。沉镍前需加Na2CO3控制溶液pH范围为___________。
(3)从滤液A中可回收利用的主要物质是Na2CO3和___________。
(4)“氧化”生成Ni2O3的离子方程式为___________。
(5)工业上用镍为阳极,电解0.05~0.1 mol·L-1 NiCl2 溶液与一定量NH4Cl组成的混合溶液,可得到高纯度、球形的超细镍粉。当其它条件一定时,NH4Cl的浓度对阴极电流效率及镍的成粉率的影响如右图所示,则NH4Cl的浓度最好控制为___________。

(6)如果在“沉镍”步骤把Na2CO3改为加草酸,则可以制得草酸镍晶体(NiC2O4·2H2O)。草酸镍晶体在热空气中干燥脱水后在高温下煅烧三小时,可以制得Ni2O3,同时获得混合气体。草酸镍晶体受热分解的化学方程式为 ___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图甲和图乙表示的是元素的某种性质随原子序数的变化。下列说法正确的是
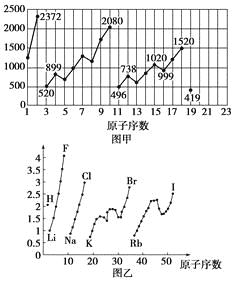
A. 图甲可能表示的是元素原子的第一电离能随原子序数的变化关系
B. 图甲可能表示的是元素单质的熔点随原子序数的变化关系
C. 图乙可能表示的是元素原子的半径随原子序数的变化关系
D. 图乙不可能表示同族元素的电负性随原子序数的变化关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2·6H2O的工艺流程如下:
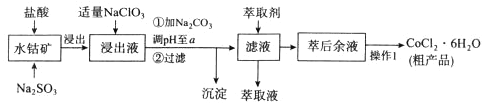
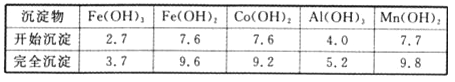
已知:①浸出液含有的阳离子主要有H+、CO2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表(金属离子浓度为0.01 mol/L):
③CoCI2.6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
(1)写出浸出过程中Co2O3发生反应的离子方程式: 。
(2)写出NaClO3发生反应的主要离子方程式: ;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式: 。
(3)惰性电极电解CoCl2溶液的阳极电极反应式为 。
(4)“操作1”中包含3个基本实验操作,它们依次是 、 和过滤。制得的CoCl2·6H2O在烘干时需减压烘干的原因是 。
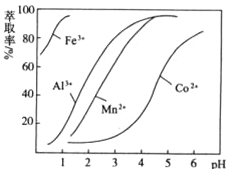
(5)萃取剂对金属离子的萃取率与pH的关系如图向“滤液”中加入萃取剂的目的是 ,其使用的最佳pH范围是 。
A.2.0~2.5 | B.3.0~3.5 |
C.4.0~4.5 | D.5.0~5.5 |
(6)力测定粗产品中CoCl2·H2O的含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是 。(答一条即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用某有机物之间的转换可以贮存太阳能,如降冰片二烯(NBD)经太阳光照可转化成四环烷(Q),其反应式可表示为: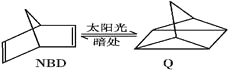 ΔH=+88.62 kJ/mol下列有关说法不正确的是
ΔH=+88.62 kJ/mol下列有关说法不正确的是
A.一定条件下,1 mol NBD最多可与2 mol Br2发生加成反应
B.物质Q的能量比NBD的低
C.物质Q的一氯取代物只有3种
D.NBD和Q二者互为同分异构体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com