
【题目】实验室常用MnO2与浓盐酸反应来制备氯气:MnO2+4HCl=MnCl2+2H2O+Cl2↑,在此反应中:
(1)氧化产物是;
(2)氧化剂与还原剂的物质的量之比为;
(3)用双线桥法标出电子转移的方向和数目:;
(4)若要产生112mL氯气,则转移的电子数目是;
(5)将此反应改写成离子方程式
【答案】
(1)Cl2
(2)1:2
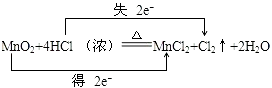
(3)
(4)0.01NA
(5)MnO2+4H++Cl﹣=Mn2++2H2O+Cl2↑
【解析】解:反应MnO2+4HCl═MnCl2+Cl2+2H2O中,Mn元素化合价降低,被还原,MnO2为氧化剂,Cl元素化合价升高,被氧化,HCl为还原剂,Cl2为氧化产物,MnCl2为还原产物,氧化剂与还原剂的物质的量之比为 1:2,氧化剂和还原剂得失电子数目相等,由元素化合价的变化可知转移的电子数目为2,用“双线桥法”表示氧化还原反应中电子转移情况为: 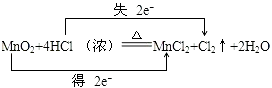 ,所以答案是:(1)Cl2;(2)1:2 (3)
,所以答案是:(1)Cl2;(2)1:2 (3)  ;(4)根据HCl中Cl元素化合价升高生成Cl2 , 所以若要产生112mL氯气,则转移的电子数目是
;(4)根据HCl中Cl元素化合价升高生成Cl2 , 所以若要产生112mL氯气,则转移的电子数目是 ![]() ×2=0.01NA , 所以答案是:0.01NA;(5)反应MnO2+4HCl═MnCl2+Cl2+2H2O中,改写成离子方程式为MnO2+4H++Cl﹣=Mn2++2H2O+Cl2↑,所以答案是:MnO2+4H++Cl﹣=Mn2++2H2O+Cl2↑.
×2=0.01NA , 所以答案是:0.01NA;(5)反应MnO2+4HCl═MnCl2+Cl2+2H2O中,改写成离子方程式为MnO2+4H++Cl﹣=Mn2++2H2O+Cl2↑,所以答案是:MnO2+4H++Cl﹣=Mn2++2H2O+Cl2↑.


科目:高中化学 来源: 题型:
【题目】过氧化钙在工农业生产中有广泛的用途。
(1)过氧化钙制备方法很多。
①制备方法一:H2O2溶液与过量的Ca(OH)2悬浊液反应可制备CaO2·8H2O,其化学方程式为:_________。
②制备方法二:利用反应Ca(s)+O2 ![]() CaO2(s),在纯氧条件下制取CaO2,实验室模拟装置示意图如下:
CaO2(s),在纯氧条件下制取CaO2,实验室模拟装置示意图如下:
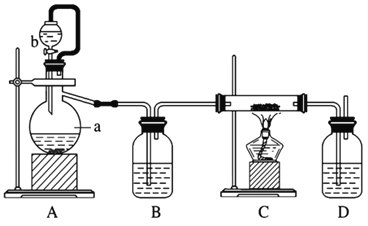
请回答下列问题:
装置A中反应的化学方程式为_________,仪器a的名称为 ________。装置D中盛有的液体是浓硫酸,其作用一是观察氧气的流速,判断氧气通入是否过快及氧气与钙反应进行的程度;二是____________。
(2)水中溶氧量(DO)是衡量水体白净能力的一个指标,通常用每升水中溶解氧分子的质量表示,单位mg·L-1。测定原理为:
①碱性条件下,O2将Mn2+氧化为MnO(OH)2:2Mn2++O2+4OH-=2MnO(OH)2↓;
②酸性条件下,MnO(OH)2将I-氧化为I2:MnO(OH)2+2I-+4H+=Mn2++I2+3H2O;
③用Na2S2O2标准溶液滴定生成的I2:2S2O32-+I2=S4O62-+2I-。
水产运输中常向水中加一定量CaO2·8H2O作供氧剂,取此水样100.0 mL,按上述方法测定水中溶氧量,消耗0.01000 mol/L Na2S2O2标准溶液13.50 mL。
滴定过程中使用的指示剂是________;该水样中的溶解氧量(DO)为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用环己醇(沸点:160.84℃,微溶于水)制备环己酮(沸点:155.6℃,微溶于水),使用的氧化剂可以是次氯酸钠、重铬酸钾等。

下列装置分别是产品的合成装置和精制装置示意图:

合成实验过程如下:
向装有搅拌器、滴液漏斗和温度计的三颈烧瓶中依次加入5.2 mL环己醇和25 mL冰醋酸。开动搅拌器,将40 mL次氯酸钠溶液逐渐加入到反应瓶中,并使瓶内温度维持在30~35℃,用磁性搅拌器搅拌5 min。然后,在室温下继续搅拌30 min后,在合成装置中再加入30 mL水、3g氯化铝和几粒沸石,加热蒸馏至馏出液无油珠滴出为止。回答下列问题:
(1)在合成装置中,甲装置的名称是__________________。
(2)三颈烧瓶的容量为____________(填“50 mL"、“100 mL”或“250 mL")。
(3)滴液漏斗具有特殊的结构,主要目的是__________。
(4)蒸馏完成后,向馏出液中分批加入无水碳酸钠至反应液呈中性为止,其目的是_________。然后加入精制食盐使之变成饱和溶液,其目的是________。再将混合液倒入分液漏斗中,分离得到有机层。
(5)有机层先加无水MgSO4,用如上右图对粗产品进行精制,加入无水MgSO4的作用是_____。检验精制后的坏己酮是否纯净,可使用的试剂为________________。
A.重铬酸钾溶液B.金属钠C.酚酞溶液 D.新制的氢氧化铜悬浊液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类生产、生活、社会可持续发展密切相关。下列说法正确的是
A.稀的食盐水能杀死H7N9禽流感病毒
B.煤经过分馏和干馏两个物理变化,可变为清洁能源
C.电镀厂的废水直接用来灌溉农田,可提高水的利用率
D.用CO2合成聚碳酸酯可降解塑料,有利于减少白色污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中进行可逆反应:2NO2(g)![]() 2NO(g)+O2(g),下列不能说明该反应已达到平衡状态的是
2NO(g)+O2(g),下列不能说明该反应已达到平衡状态的是
A. 混合气体的颜色不再改变 B. 混合气体的密度不再改变
C. 混合气体的压强不再改变 D. 混合气体的平均摩尔质量不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)暴露于空气中会与氧气反应生成硝酸钠,在纤维纺织品的染色和漂白、照相、生产橡胶、制药等领域有广泛应用,也常用于鱼类、肉类等食品的染色和防腐。但因其有毒,所以在食品行业用量有严格限制。现用下图所示仪器(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及气体产物成分。
已知:①NO+NO2+2OH—==2NO2—+H2O ②气体液化的温度:NO2:21℃,NO:-152℃
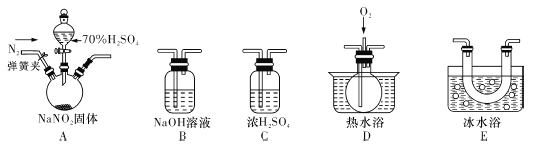
(1)为了检验装置A中生成的气体产物,仪器的连接顺序(按左→右连接):A、C、 、 、 。
(2)反应前应打开弹簧夹,先通人一段时间氮气,排除装置中的空气,目的是 。
(3)在关闭弹簧夹,打开分液漏斗活塞,滴人70%硫酸后,A中产生红棕色气体。
①确认A中产生的气体含有NO,依据的现象是 。
②装置E的作用是 。
(4)如果向D中通入过量O2,则装置B中发生反应的化学方程式为 。如果没有装置C,对实验结论造成的影响是 。
(5)通过上述实骏探究过程,可得出装置A中反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油炼制过程中产生的大量H2S废气的处理设计方案如下图所示,下列说法不合理的是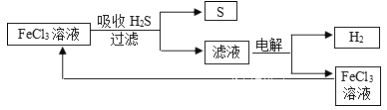
A. 吸收H2S的离子方程式为:2Fe3++H2S=2Fe2++S↓+2H+
B. 电解过程中的阳极可发生的竞争反应主要为:2Cl--2e-=Cl2↑
C. 该工艺流程设计上处理废气H2S的同时也获得产品H2和S
D. 实验室可用点燃充分燃烧的方法消除H2S污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】单质到盐的一种转化关系如图所示,

完全符合图示转化关系正确的是:
A. C、Ca、Na B. S、Cu、Si C. Cl、Fe、Cu D. Na、S、N
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com