
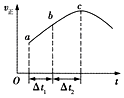
 向绝热恒容密闭容器中通入CO和H2O(g),在一定条件下使反应CO(g)+H2O(g)?CO2(g)+H2(g)达到判平衡,正反应速率随时间变化的示意图如图所示.由图可得出的正确结论是( )
向绝热恒容密闭容器中通入CO和H2O(g),在一定条件下使反应CO(g)+H2O(g)?CO2(g)+H2(g)达到判平衡,正反应速率随时间变化的示意图如图所示.由图可得出的正确结论是( )| A. | 反应物的总能量低于生成物的总能量 | |
| B. | △t1=△t2时,CO的转化率:a~b段小于b〜c段 | |
| C. | 反应在c点达到平衡状态 | |
| D. | 反应物浓度:a点小于b点 |
分析 由题意可知一个反应前后体积不变的可逆反应,由于容器恒容,因此压强不影响反应速率,所以在本题中只考虑温度和浓度的影响.结合图象可知反应速率先增大再减小,因为只要开始反应,反应物浓度就要降低,反应速率应该降低,但此时正反应却是升高的,这说明此时温度的影响是主要的,由于容器是绝热的,因此只能是放热反应,从而导致容器内温度升高反应速率加快.
解答 解:A.从a到c正反应速率增大,之后正反应速率减小,说明反应刚开始时温度升高对正反应速率的影响大于浓度减小对正反应速率的影响,说明该反应为放热反应,即反应物的总能量高于生成物的总能量,故A错误;
B.着反应的进行,正反应速率越快,消耗的CO就越多,CO的转化率将逐渐增大,所以△t1=△t2时,CO的转化率:a~b段小于b〜c段,故B正确;
C.a化学平衡状态的标志是各物质的浓度不再改变,其实质是正反应速率等于逆反应速率,c点对应的正反应速率显然还在改变,故一定未达平衡,故C错误;
D.随到b时正反应速率增加,反应物浓度随时间不断减小,所以反应物浓度:a点大于b点,故D错误;
故选B.
点评 本题考查化学反应速率和平衡图象,注意该反应的特点及反应限制条件,一定要读懂,“绝热恒容密闭容器”这句话表达的含义,难度较大.


 每课必练系列答案
每课必练系列答案科目:高中化学 来源: 题型:选择题
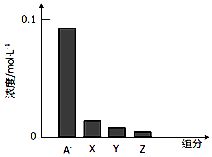
| A. | HA是弱酸 | B. | 该混合液pH>7 | ||
| C. | 该混合溶液中:c(A-)+c(Y)=c(Na+) | D. | 图中X表示HA,Y表示OH-,Z表示H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| A | ||
| E |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
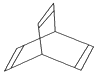 有一种有机物X的键线式如图所示.
有一种有机物X的键线式如图所示. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H3=△H1+2△H2 x=xy2 | B. | H3=△H1+△H2 z=x+y | ||
| C. | H3=△H1+2△H2 x=x-y2 | D. | H3=△H1+△H2 z=$\frac{x}{y}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 核内质子数与中子数之差为136 | |
| B. | 氡元素位于元素周期表中第六周期Ⅷ族 | |
| C. | 氡气的分子式为Rn2 | |
| D. | 氡元素性质稳定,很难与其他元素化合 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2;元素Y基态原子的3p轨道上有4个电子.X与Y形成的化合物的晶胞如图所示,下列关于该晶体的说法正确的是( )
元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2;元素Y基态原子的3p轨道上有4个电子.X与Y形成的化合物的晶胞如图所示,下列关于该晶体的说法正确的是( )| A. | 1个晶胞中离子的总数为18 | |
| B. | X2+离子的配位数为8,Y2-离子的配位数为4 | |
| C. | 与每个X2+距离最近的X2+共有12个 | |
| D. | 该化合物的化学式为CaS |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com