
| A. | 核内质子数与中子数之差为136 | |
| B. | 氡元素位于元素周期表中第六周期Ⅷ族 | |
| C. | 氡气的分子式为Rn2 | |
| D. | 氡元素性质稳定,很难与其他元素化合 |
分析 A.原子中质子数和中子数之和为质量数,原子符号左上角为质量数,左下角为质子数;
B.氡元素原子序数=质子数=86.原子核外有6个电子层,最外层8个电子;
C.稀有气体为单原子分子;
D.稀有气体结构为稳定结构,性质稳定.
解答 解:A.质量数为222,质子数为86,中子数=222-86=136,核内质子数与中子数之差为50,故A错误;
B.氡元素原子序数=质子数=86.原子核外有6个电子层,最外层8个电子,位于元素周期表中第六周期0族,故B错误;
C.稀有气体为单原子分子氡气的分子式为Rn,故C错误;
D.氡原子结构为稳定结构,氡元素性质稳定,很难与其他元素化合,故D正确;
故选D.
点评 本题考查原子的表示方法和同位素的概念,题目难度不大,明确原子的表示方法和A=Z+N是解题的关键.


 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:填空题
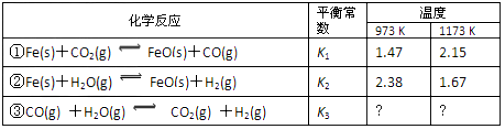
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
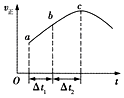 向绝热恒容密闭容器中通入CO和H2O(g),在一定条件下使反应CO(g)+H2O(g)?CO2(g)+H2(g)达到判平衡,正反应速率随时间变化的示意图如图所示.由图可得出的正确结论是( )
向绝热恒容密闭容器中通入CO和H2O(g),在一定条件下使反应CO(g)+H2O(g)?CO2(g)+H2(g)达到判平衡,正反应速率随时间变化的示意图如图所示.由图可得出的正确结论是( )| A. | 反应物的总能量低于生成物的总能量 | |
| B. | △t1=△t2时,CO的转化率:a~b段小于b〜c段 | |
| C. | 反应在c点达到平衡状态 | |
| D. | 反应物浓度:a点小于b点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | α1、α2均减小,c1、c2均增大 | B. | α1、α2均增大,c1、c2均减小 | ||
| C. | α1减小,α2增大,c1、c2均增大 | D. | α1减小,α2增大,c1增大,c2减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
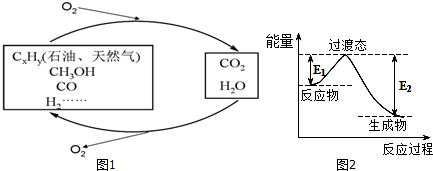
| C-H | C-O | C=O | H-H | H-O |
| 413.4 | 351 | 745 | 436 | 462.8 |
| 实验 | 温度/℃ | 起始量] | 达到平衡 | |||
| CO/mol | H2O/mol | H2/mol | CO转化率 | 所需时间/min | ||
| 1 | 650 | 4 | 2 | 1.6 | 6 | |
| 2 | 900 | 2 | 1 | 25% | 3 | |
| 3 | 900 | a | b | c | t | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
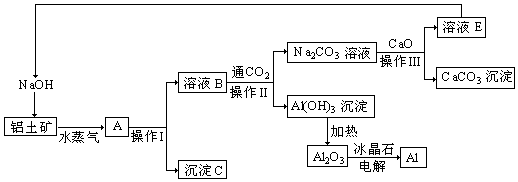
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氦原子的相对原子质量是$\frac{12a}{b}$ | B. | 氦气的摩尔质量是(ρVm) g/mol | ||
| C. | m g氦气所含质子数是$\frac{2m}{b}$ | D. | m g氦气的物质的量是$\frac{m}{(b{N}_{A})}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都是红褐色 | B. | 都不能透过半透膜 | ||
| C. | 分散质的粒子都能通过滤纸 | D. | 都能产生丁达尔效应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com