
| A. | 都是红褐色 | B. | 都不能透过半透膜 | ||
| C. | 分散质的粒子都能通过滤纸 | D. | 都能产生丁达尔效应 |
分析 A.氯化铁为黄色,氢氧化铁胶体为红褐色;
B.根据胶体不能通过半透膜,溶液可以通过分析解答;
C.胶体和溶液都可以透过滤纸;
D.只有胶体具有丁达尔效应,溶液不具备;
解答 解:A.因FeCl3溶液与Fe(OH)3胶体的颜色分别为棕黄色、红褐色,故A错误;
B.FeCl3溶液通过半透膜,Fe(OH)3胶体不能通过半透膜,故B错误;
C.Fe(OH)3胶体和FeCl3溶液都能透过滤纸,浊液不能通过滤纸,故C正确.
D.只有胶体具有丁达尔效应,所以Fe(OH)3胶体具有丁达尔效应,而FeCl3溶液不具备,故D错误;
故选C.
点评 本题考查了胶体的性质以及胶体和溶液的区别,题目难度不大,掌握胶体的性质是解题的关键.


 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:选择题
| A. | 核内质子数与中子数之差为136 | |
| B. | 氡元素位于元素周期表中第六周期Ⅷ族 | |
| C. | 氡气的分子式为Rn2 | |
| D. | 氡元素性质稳定,很难与其他元素化合 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2;元素Y基态原子的3p轨道上有4个电子.X与Y形成的化合物的晶胞如图所示,下列关于该晶体的说法正确的是( )
元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2;元素Y基态原子的3p轨道上有4个电子.X与Y形成的化合物的晶胞如图所示,下列关于该晶体的说法正确的是( )| A. | 1个晶胞中离子的总数为18 | |
| B. | X2+离子的配位数为8,Y2-离子的配位数为4 | |
| C. | 与每个X2+距离最近的X2+共有12个 | |
| D. | 该化合物的化学式为CaS |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,1L 0.1mol/L HCl溶液中含氢原子数是0.1NA | |
| B. | 标准状况下,2.24L由CO2和O2组成的混合气体中含氧分子数是0.1NA | |
| C. | 10g碳酸钙与足量的稀盐酸充分反应消耗的氢离子数为0.1NA | |
| D. | 标准状况下,11.2L CO和 NO混合气体中与11.2LN2中分子数均为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两种气体的压强相等 | B. | O2和O3的原子个数相等 | ||
| C. | 两种气体的氧化能力相同 | D. | 两种气体的分子数目相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 2F2+2H2O═4HF+O2 | B. | AgNO3+NaCl═AgCl↓+NaNO3 | ||
| C. | 3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | D. | MgCl2(熔融)$\frac{\underline{\;高温\;}}{\;}$Mg+Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6.72L CO | B. | 6.6gCO2 | C. | 8gSO3 | D. | 9.8gH2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
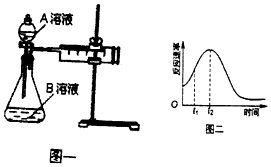
| 实验序号 | A溶液 | B溶液 |
| ① | 20 mL 0.1 mol•L-1H2C2O4溶液 | 30 mL 0.01 mol•L-1kMnO4溶液 |
| ② | 20 mL 0.2 mol•L-1 H2C2O4溶液 | 30 mL 0.01 mol•L-1KMnO4溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com