
【题目】难挥发性二硫化钽(TaS2)可采用如下装置提纯.将不纯的TaS2粉末装入石英管一端,抽真空后引入适量碘并封管,置于加热炉中.反应如下:TaS2(s)+2I2(g)TaI4(g)+S2(g)下列说法正确的是( )![]()
A.在不同温度区域,TaI4的量保持不变
B.在提纯过程中,I2的量不断减少
C.在提纯过程中,I2的作用是将TaS2从高温区转移到低温区
D.该反应的平衡常数与TaI4和S2的浓度乘积成反比
【答案】C
【解析】A、根据反应条件可知当温度不同时反应进行的主要方向不同,TaI4的量改变,A不符合题意;
B、因为是在同一密闭系统中有质量守恒定律可知I2的量不可能不断减少,在一定条件下达到平衡后不再变化,B不符合题意;
C、在提纯过程中,I2的作用是充当一个“搬运工”的角色,将TaS2从高温区转移到低温区以达到提纯的目的,C符合题意;
D、根据平衡常数表达式可知,平衡常数用平衡时生成物的浓度幂次方乘积除以反应物平衡浓度的幂次方乘积,所以平衡常数K与Tal4和S2的浓度乘积成正比,D不符合题意;
所以答案是:C.
【考点精析】解答此题的关键在于理解化学平衡常数的含义的相关知识,掌握指在一定条件下的可逆反应里,正反应和逆反应的速率相等,反应混合物中各组分的浓度不变的状态.


科目:高中化学 来源: 题型:
【题目】共价键、离子键和范德华力都是粒子之间的不同作用力,下列物质同时含有上述两种作用力的组合是( )
①Na2O2 ②SiO2 ③石墨 ④金刚石 ⑤食盐 ⑥白磷
A. ①②④ B. ①③⑥
C. ②④⑥ D. ③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Al-Ag2O电池是一种可用作水下动力的优良电源,其原理如图所示。该电池工作时总反应式为2Al+3Ag2O+2NaOH=2NaAlO2+6Ag+H2O,则下列说法错误的是 ( )
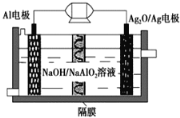
A. 工作时正极发生还原反应,且正极质量逐渐减小
B. 当电极上生成1.08 g Ag时,电路中转移的电子为0.01 mol
C. Al电极做负极,电极反应式为:Al-3e-=Al3+
D. 工作时电解液中的Na+移向Ag2O/Ag电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将V1ml 1.00mol/LHCl溶液和V2ml未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50ml),下列叙述正确的是( )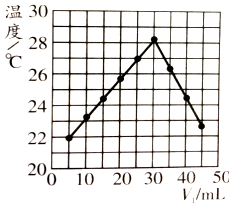
A.实验操作时的环境温度为22℃
B.实验表明热能可转化为化学能
C.该实验表明有水生成的反应都是放热反应
D.NaOH溶液的浓度约为1.50 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】布洛芬片常用来减轻感冒症状,其结构简式如图,下列有关说法错误的是( )

A. 布洛芬的分子式为C13H18O2
B. 布洛芬与乙酸是同系物
C. 1mol布洛芬最多能与3mol氢气发生加成反应
D. 该物质苯环上的一氯代物有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1 molX气体跟amolY气体在体积可变的密闲容器中发生如下反应X( g) +aY(g)=bZ(g),反应达到平衡后,测得X的转化率为50%。而且,在同温同压下还测得前混合气体的密度是反应后混合气体密度的3/4,则a和b的数值可能是
A. a = 2,b = 1 B. a=39,b =2 C. a=2,b = 2 D. a=3,b = 3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H、N、Na、Al、Ti等元素在能源、材料等领域应用广泛。回答下列问题:
(一)氢化铝钠( NaAlH4)是一种新型轻质储氢材料,掺人少量Ti的NaAlH4在150℃时释氢,在170℃、15.2 MPa条件下又重复吸氢。NaAlH4可南AlCl3和NaH在适当条件下合成。NaAlH4的品胞结构如右图所示,为长方体。

(1)基态Ti原子的价电子排布式为 ___,L能层中电子云的形状有___ 种。
(2)AlCl3在178℃时升华,属于____晶体,其蒸气的相对分子质量约为267,蒸气分子的结构式为____(标明配位键),其中Al原子的杂化方式为_______。
(3)写出与AIH4-空间构型相同的-种分子和一种离子_________(填化学式)。
(4)NaAlH4晶体中,与AlH4紧邻且等距的Na+有_______个;NaAlH4晶体的密度为 _____g/cm3(用含n的代数式表示)。
(二)叠氮化钠和氢叠氮酸( HN3)已一步步进入我们的生活,如汽车安全气囊等。
(5)写出与N3-互为等电子体的一种分子_____填分子式)。
(6)氢叠氮酸(HN3)可由肼(N2H4)被HNO2氧化制得,同时生成水。下列叙述错误的是______(填标号)
A.上述生成HN3的化学方程式为:N2H4+HNO2=HN3+2H2O
B.NaN3的晶格能大于KN3的晶格能
C.氢叠氮酸(HN3)和水能形成分子间氢键
D.HN3和N2H4都是由极性键和非极性键构成的非极性分子。
E.HN3分子中四个原子可能在一条直线上
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com