
【题目】布洛芬片常用来减轻感冒症状,其结构简式如图,下列有关说法错误的是( )

A. 布洛芬的分子式为C13H18O2
B. 布洛芬与乙酸是同系物
C. 1mol布洛芬最多能与3mol氢气发生加成反应
D. 该物质苯环上的一氯代物有2种
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,回答下列有关问题:

(1)写出下列元素名称:②_________;___________。
(2)在这些元素中,金属性最强的元素是______(用元素符号表示),元素⑨与元素⑩相比,非金属性较强的是___________(用元素符号表示)。下列表述中能证明这一事实的是______________。
a.常温下⑨的单质和⑩的单质状态不同
b. ⑩的氢化物比⑨的氢化物稳定
c.一定条件下⑨和⑩的单质都能与氢氧化钠溶液反应
(3)⑦的最高价氧化物对应水化物与⑩的最高价氧化物对应水化物反应的离子方程式为:______。
(4)②的气态氢化物与HC1在空气中相遇有白烟生成,写出白烟对应物质的电子式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2和H2合成NH3的能量变化如图所示,该反应的热化学方程式是( )
A.N2(g)+3H2(g)2NH3(g);△H=2(b﹣a) kJ/mol
B.N2(g)+3H2(g)2NH3(l);△H=2(a﹣b﹣c) kJ/mol
C.![]() N2(g)+
N2(g)+ ![]() H2(g)NH3(l);△H=(b+c﹣a) kJ/mol
H2(g)NH3(l);△H=(b+c﹣a) kJ/mol
D.![]() N2(g)+
N2(g)+ ![]() H2(g)NH3(g);△H=(a+b) kJ/mol
H2(g)NH3(g);△H=(a+b) kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】难挥发性二硫化钽(TaS2)可采用如下装置提纯.将不纯的TaS2粉末装入石英管一端,抽真空后引入适量碘并封管,置于加热炉中.反应如下:TaS2(s)+2I2(g)TaI4(g)+S2(g)下列说法正确的是( )![]()
A.在不同温度区域,TaI4的量保持不变
B.在提纯过程中,I2的量不断减少
C.在提纯过程中,I2的作用是将TaS2从高温区转移到低温区
D.该反应的平衡常数与TaI4和S2的浓度乘积成反比
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烷烃相对分子质量为86,如果分子中含有3个—CH3、2个—CH2—和1个![]() ,则符合该结构的所有烷烃的一氯取代物总共有几种( )
,则符合该结构的所有烷烃的一氯取代物总共有几种( )
A. 10种 B. 9种 C. 8种 D. 7种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项实验基本操作中,正确的是
A. 为了加快锌和稀硫酸反应的速率,可以向稀硫酸中加入少量硫酸铜![]()
B. 在做中和滴定实验时清洗滴定管后,直接装液滴定
C. 为了加快过滤速度,用玻璃棒搅拌过滤器中的液体
D. 为了使配制的氯化铁溶液保持澄清,加入盐酸和铁片
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A(C2H4)是基本的有机化工原料,由A制备聚丙烯酸甲酯(有机玻璃主要成分)和肉桂酸的合成路线(部分反应条件略去)如下图所示:
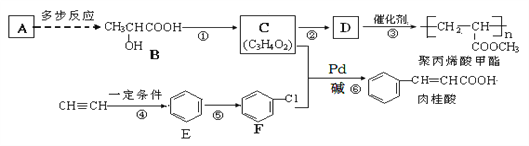
已知:![]() (X为卤原子,R为取代基)
(X为卤原子,R为取代基)![]()
回答下列问题:
(1)B中含氧官能团的名称是____________;反应①的反应条件是__________________;⑥的反应类型是_________。![]()
(2)肉桂酸的化学式为_______________;由C制取D的化学方程式为__________________________________________。
(3)肉桂酸的同分异构体中能同时满足下列条件:①苯环上有两个取代基②能发生银镜反应,③苯环上有两种不同环境的氢。请写出一种符合上述要求物质的结构简式:_______________________________。
(4)请你设计一个由丙烯(CH2=CH-CH3)制备B的合成路线(无机试剂任选)___________。合成路线常用的表示方式为:![]()
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象和结论均正确的是
选项 | 实验操作 | 现象或化学方程式 | 结论 |
A | 取1mL20%的蔗糖溶液,加入适量稀硫酸,水浴加热后取少量溶液,加入几滴新制Cu(OH)2悬浊液,加热 | 溶液中未出现砖红色沉淀 | 蔗糖未水解 |
B | 将C和SiO2的固体混合物高温加热 | 2C+SiO2 | 非金属性:C>Si |
C | 向盛有2mL0.1mol/L的NaCl溶液的试管中逐滴加入几滴0.1mol/L的AgNO3溶液,充分反应后,再逐滴加入0.1mol/L的KI溶液 | 白色沉淀变为黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
D | 向待测液中加入适量的稀NaOH溶液,将|湿润的蓝色石蕊试纸放在试管口 | 湿润的蓝色石蕊试纸未变红 | 在待测液中不存在NH4+ |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁烯是一种重要的化工原料,可由丁烷催化脱氢制备.回答下列问题:
(1)正丁烷(C4H10)脱氢制1﹣丁烯(C4H8)的热化学方程式如下:
①C4H10(g)=C4H8(g)+H2(g)△H1
已知:②C4H10(g)+ ![]() O2(g)=C4H8(g)+H2O(g)△H2=﹣119kJmol﹣1
O2(g)=C4H8(g)+H2O(g)△H2=﹣119kJmol﹣1
③H2(g)+ ![]() O2(g)=H2O(g)△H3 =﹣242kJmol﹣1
O2(g)=H2O(g)△H3 =﹣242kJmol﹣1
反应①的△H1为 kJmol﹣1 . 图(a)是反应①平衡转化率与反应温度及压强的关系图,x0.1(填“大于”或“小于”);欲使丁烯的平衡产率提高,应采取的措施是(填标号).
A.升高温度B.降低温度C.增大压强D.降低压强
(2)丁烷和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用是活化催化剂),出口气中含有丁烯、丁烷、氢气等.图(b)为丁烯产率与进料气中n(氢气)/n(丁烷)的关系.图中曲线呈现先升高后降低的变化趋势,其降低的原因是 .
(3)图(c)为反应产率和反应温度的关系曲线,副产物主要是高温裂解生成的短碳链烃类化合物.丁烯产率在590℃之前随温度升高而增大的原因可能是;590℃之后,丁烯产率快速降低的主要原因可能是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com