
����Ŀ������ʵ�����������ͽ��۾���ȷ����
ѡ�� | ʵ����� | �����ѧ����ʽ | ���� |
A | ȡ1mL20%��������Һ,��������ϡ���ᣬˮԡ���Ⱥ�ȡ������Һ�����뼸������Cu(OH)2����Һ������ | ��Һ��δ����ש��ɫ���� | ����δˮ�� |
B | ��C��SiO2�Ĺ���������¼��� | 2C+SiO2 | �ǽ����ԣ�C>Si |
C | ��ʢ��2mL0.1mol/L��NaCl��Һ���Թ�����μ��뼸��0.1mol/L��AgNO3��Һ����ַ�Ӧ������μ���0.1mol/L��KI��Һ | ��ɫ������Ϊ��ɫ���� | Ksp(AgCl)>Ksp(AgI) |
D | �����Һ�м���������ϡNaOH��Һ����|ʪ�����ɫʯ����ֽ�����Թܿ� | ʪ�����ɫʯ����ֽδ��� | �ڴ���Һ�в�����NH4+ |
A. A B. B C. C D. D
���𰸡�C
������������ˮ�����������ǣ�������������Cu(OH)2����Һ��ӦӦ�ڼ��������½��У���ʵ��û���ü�Һ�к����ᣬ���Դﲻ��ʵ��Ŀ�ģ�A�����ڸ��������£�̼�ܹ��û���SiO2�еĹ裬̼���ֳ���ԭ�ԣ������ø÷�Ӧ�ȽϷǽ�����ǿ����B�������ܽ�ȴ��������ת��Ϊ�ܽ��С������,����ʵ���֪,�����ɰ�ɫ����AgCl����ת��Ϊ��ɫ����AgI���������������γ����ܽ�ƽ�ⳣ����С˳����Ksp(AgCl)>Ksp(AgI)��C��ȷ��������Һ�е� NH4+ʱ,Ӧ�ü���ŨNaOH��Һ,���ʵ�����,��������������ʹʪ��ĺ�ɫʯ����ֽ����,��֤������������к���NH4+��D��������ȷѡ��C��


 �ο�������ϵ�д�
�ο�������ϵ�д� ������ѧ��ʱ��ҵϵ�д�
������ѧ��ʱ��ҵϵ�д� ���������ʱ��ѵϵ�д�
���������ʱ��ѵϵ�д� �㽭�¿γ���άĿ�������ʱ��ѵϵ�д�
�㽭�¿γ���άĿ�������ʱ��ѵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Al��Ag2O�����һ�ֿ�����ˮ�¶�����������Դ����ԭ����ͼ��ʾ���õ�ع���ʱ�ܷ�ӦʽΪ2Al��3Ag2O��2NaOH=2NaAlO2��6Ag��H2O��������˵��������� (����)
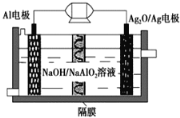
A. ����ʱ����������ԭ��Ӧ��������������С
B. ���缫������1.08 g Agʱ����·��ת�Ƶĵ���Ϊ0.01 mol
C. Al�缫���������缫��ӦʽΪ��Al��3e��=Al3+
D. ����ʱ���Һ�е�Na������Ag2O/Ag�缫
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ƭ�����������ð֢״����ṹ��ʽ��ͼ�������й�˵��������ǣ� ��

A. ����ҵķ���ʽΪC13H18O2
B. �������������ͬϵ��
C. 1mol������������3mol���������ӳɷ�Ӧ
D. �����ʱ����ϵ�һ�ȴ�����2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1 molX�����amolY����������ɱ�����������з������·�ӦX( g) +aY(g)=bZ(g),��Ӧ�ﵽƽ����X��ת����Ϊ50%�����ң���ͬ��ͬѹ�»����ǰ���������ܶ��Ƿ�Ӧ���������ܶȵ�3/4����a��b����ֵ������
A. a = 2��b = 1 B. a=39��b =2 C. a=2��b = 2 D. a=3��b = 3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼��ơ���������ѧ��ѧʵ���еij����Լ���
��1����ͬѧ��ⶨCaCO3���������0.1molL��1 HCl�ķ�Ӧ���ʣ�
�ٸ÷�Ӧ�����ӷ���ʽΪ ��
�����ʵ�鷽����ͨ���������㷴Ӧ����
��2����ͬѧ������ͼװ��̽�����������ͷ�Ӧ��Ũ�ȶԻ�ѧ��Ӧ���ʵ�Ӱ�죮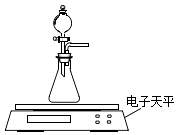
������ƽ��ѡ�Լ�����Ʒ��0.1molL��1 HCl������״CaCO3����ĩ״CaCO3������ˮ����Ͳ�����
��i�����ʵ�鷽�����ڷ�Ӧ��Ũ�Ȼ����������ͬ�������£��ⶨ
��Ҫ������õ�������ֱ�����ַ�Ӧ���ʴ�С����
������ ���ݣ�i������Ƶ�ʵ��ⶨ�������ⶨʵ�������������ʵ�鷽�����г������Լ�����������������������������ĸa��b��c��d��ʾ��
��֪ʵ��1��2̽�����������Է�Ӧ���ʵ�Ӱ�죻
ʵ��1��3̽����Ӧ��Ũ�ȶԷ�Ӧ���ʵ�Ӱ�죮
д�����Т٩����������ı�Ҫ���ݻ�������
������ | V��0.1molL��1 HCl��/mL | m������״CaCO3��/g | m����ĩ״CaCO3��/g | V������ˮ��/mL | �� | �� |
ʵ��1 | a | b | 0 | c | d | |
ʵ��2 | �� | 0 | �� | c | d | |
ʵ��3 | c | �� | 0 | �� | d |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��·�Ӧ4A(s)+3B(g)![]() 2C(g)+D(g)��2minB��Ũ�ȼ���0.6mol��L-1���Դ˷�Ӧ���ʵı�ʾ��ȷ���ǣ� ��
2C(g)+D(g)��2minB��Ũ�ȼ���0.6mol��L-1���Դ˷�Ӧ���ʵı�ʾ��ȷ���ǣ� ��
A. ��A��ʾ�ķ�Ӧ������0.4mol��L-1��min-1
B. �ֱ���B��C��D��ʾ��Ӧ�����ʣ����ֵ��1��2��3
C. 2minĩ�ķ�Ӧ����v(B)=0.3mol��L-1��min-1
D. ����2min����һ��ʱ������B��C��ʾ������Ӧ���ʵ�ֵ��ʱ��仯������С��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ڹ����β��ϵ���
A. ̼��ά B. ʯ��ʯ C. ��ͨˮ�� D. ʯӢ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��H��N��Na��Al��Ti��Ԫ������Դ�����ϵ�����Ӧ�ù㷺���ش��������⣺
��һ���⻯����( NaAlH4)��һ���������ʴ�����ϣ���������Ti��NaAlH4��150��ʱ���⣬��170�桢15.2 MPa���������ظ����⡣NaAlH4����AlCl3��NaH���ʵ������ºϳɡ�NaAlH4��Ʒ���ṹ����ͼ��ʾ��Ϊ�����塣

(1)��̬Tiԭ�ӵļ۵����Ų�ʽΪ ___��L�ܲ��е����Ƶ���״��___ �֡�
(2)AlCl3��178��ʱ����������____���壬����������Է�������ԼΪ267���������ӵĽṹʽΪ____��������λ����������Alԭ�ӵ��ӻ���ʽΪ_______��
(3)д����AIH4-�ռ乹����ͬ��-�ַ��Ӻ�һ������_________���ѧʽ����
(4)NaAlH4�����У���AlH4�����ҵȾ��Na+��_______����NaAlH4������ܶ�Ϊ _____g/cm3(�ú�n�Ĵ���ʽ��ʾ)��
�������������ƺ��������( HN3)��һ�����������ǵ������������ȫ���ҵȡ�
(5)д����N3-��Ϊ�ȵ������һ�ַ���_____�����ʽ����
(6)������ᣨHN3)������(N2H4)��HNO2�����Ƶã�ͬʱ����ˮ�����������������______�����ţ�
A.��������HN3�Ļ�ѧ����ʽΪ��N2H4+HNO2=HN3+2H2O
B.NaN3�ľ����ܴ���KN3�ľ�����
C.�������(HN3)��ˮ���γɷ��Ӽ����
D.HN3��N2H4�����ɼ��Լ��ͷǼ��Լ����ɵķǼ��Է��ӡ�
E.HN3�������ĸ�ԭ�ӿ�����һ��ֱ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������13C��˵����ȷ����
A. ������Ϊ6 B. ������Ϊ6 C. ������Ϊ13 D. ������Ϊ6
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com