
【题目】一定温度下反应4A(s)+3B(g)![]() 2C(g)+D(g)经2minB的浓度减少0.6mol·L-1,对此反应速率的表示正确的是( )
2C(g)+D(g)经2minB的浓度减少0.6mol·L-1,对此反应速率的表示正确的是( )
A. 用A表示的反应速率是0.4mol·L-1·min-1
B. 分别用B、C、D表示反应的速率,其比值是1∶2∶3
C. 2min末的反应速率v(B)=0.3mol·L-1·min-1
D. 在这2min任意一段时间内用B和C表示的正反应速率的值随时间变化都是逐渐减小的
 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】A、B均为短周期元素中的一种,已知A的原子序数为n,A2+离子比B2-离子少8个电子,则B的原子序数为
A. n+4B. n+6C. n+8D. n+10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项实验基本操作中,正确的是
A. 为了加快锌和稀硫酸反应的速率,可以向稀硫酸中加入少量硫酸铜![]()
B. 在做中和滴定实验时清洗滴定管后,直接装液滴定
C. 为了加快过滤速度,用玻璃棒搅拌过滤器中的液体
D. 为了使配制的氯化铁溶液保持澄清,加入盐酸和铁片
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若把周期表原先的主、副族序号取消,由左到右按原顺序编为18列。如碱金属为第一列稀有气体为第18列,按这个规定,下列说法中不正确的是
A.第10列元素全部是金属元素
B.第18列元素单质全部是气体
C.只有第2列元素的原子最外层有2个电子
D.第3列元素种类数最多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象和结论均正确的是
选项 | 实验操作 | 现象或化学方程式 | 结论 |
A | 取1mL20%的蔗糖溶液,加入适量稀硫酸,水浴加热后取少量溶液,加入几滴新制Cu(OH)2悬浊液,加热 | 溶液中未出现砖红色沉淀 | 蔗糖未水解 |
B | 将C和SiO2的固体混合物高温加热 | 2C+SiO2 | 非金属性:C>Si |
C | 向盛有2mL0.1mol/L的NaCl溶液的试管中逐滴加入几滴0.1mol/L的AgNO3溶液,充分反应后,再逐滴加入0.1mol/L的KI溶液 | 白色沉淀变为黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
D | 向待测液中加入适量的稀NaOH溶液,将|湿润的蓝色石蕊试纸放在试管口 | 湿润的蓝色石蕊试纸未变红 | 在待测液中不存在NH4+ |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,具有开发和应用的广阔前景,其合成反应为CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
(1)下表列出了一些化学键断裂需要的能量数据,则CO(g)+2H2(g)![]() CH3OH(g) △H=________。
CH3OH(g) △H=________。
化学键 | H-H | C-O | C | H-O | C-H |
E(kJ·mol-1) | 436 | 343 | 1076 | 465 | 413 |
工业上用天然气为原料合成甲醇,分为两阶段。
I制备合成气:CH4+H2O(g)=CO+3H2。
(2)为解决合成气中H2过量CO不足问题,原料气中添加CO2,发生反应CO2+H2=CO+H2O。为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为___ 。
Ⅱ合成甲醇
实验室进行模拟合成实验。将1 molCO和2molH2通人密闭容器中,测得CO在不同温度下的平衡转化率与压强的关系如图所示:
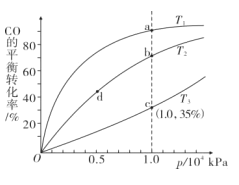
(3)比较T1、T2、T3的大小,并说明理由____。
(4)平衡常数K(b)___ K(d)、正反应速率v(a) ___v(b)(均填“大于”“小于”或“等于”)。
(5)c点时反应的压强平衡常数Kp=___ (kPa)-2(用数字表达式表示,Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(6)a点时,保持温度不变,将密闭容器的容积压缩刮原来的,对平衡体系产生的影响是______。
A. c(H2)减少 B.正反应速率加快,逆反应速率减慢
C.CH3OH的物质的量增加 D.重新平衡时![]() 减小
减小![]() E. CH3OH的体积分数增加
E. CH3OH的体积分数增加
(7)科研人员设计了一种新型甲醇燃料电池,其电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-,该电池工作时的负极电极反应式为 ________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,反应X2(g)+Y2(g)2XY(g);△H<0,达到甲平衡.在仅改变某一条件后,达到乙平衡,图中对此过程的分析正确的是( )
A.图I是加入适当催化剂的变化情况
B.图Ⅱ是扩大容器体积的变化情况
C.图Ⅲ是增大压强的变化情况
D.图Ⅲ是升高温度的变化情况
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
实验编号 | HA物质的量浓度 | NaOH物质的量浓度 | 混合溶液的pH |
甲 | 0.2 | 0.2 | pH=a |
乙 | c | 0.2 | pH=7 |
丙 | 0.2 | 0.1 | pH>7 |
丁 | 0.1 | 0.1 | pH=9 |
(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)来说明HA是强酸还是弱酸 .
(2)不考虑其它组的实验结果,单从乙组情况分析,C是否一定等于0.2(选填“是”或“否”).混合液中离子浓度c(A﹣)与 c(Na+)的大小关系是 .
(3)丙组实验结果分析,HA是酸(选填“强”或“弱”).该混合溶液中离子浓度由大到小的顺序是 .
(4)丁组实验所得混合溶液中由水电离出的c(OH﹣)=molL﹣1 . 写出该混合溶液中下列算式的精确结果(不需做近似计算).c(Na+)﹣c(A﹣)=molL﹣1 c(OH﹣)﹣c(HA)=molL﹣1 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为V L的密闭容器中通入a mol NO和b mol O2 , 发生如下反应:2NO+O2═2NO2 , 反应后容器内氮原子和氧原子数之比是( )
A.a:b
B.a:2b
C.a:(2a+2b)
D.a:(a+2b)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com