
【题目】在体积为V L的密闭容器中通入a mol NO和b mol O2 , 发生如下反应:2NO+O2═2NO2 , 反应后容器内氮原子和氧原子数之比是( )
A.a:b
B.a:2b
C.a:(2a+2b)
D.a:(a+2b)
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】一定温度下反应4A(s)+3B(g)![]() 2C(g)+D(g)经2minB的浓度减少0.6mol·L-1,对此反应速率的表示正确的是( )
2C(g)+D(g)经2minB的浓度减少0.6mol·L-1,对此反应速率的表示正确的是( )
A. 用A表示的反应速率是0.4mol·L-1·min-1
B. 分别用B、C、D表示反应的速率,其比值是1∶2∶3
C. 2min末的反应速率v(B)=0.3mol·L-1·min-1
D. 在这2min任意一段时间内用B和C表示的正反应速率的值随时间变化都是逐渐减小的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】As的原子结构示意图为![]() ,下列关于As的描述不正确的是 ( )
,下列关于As的描述不正确的是 ( )
A. 位于第四周期,第ⅤA族 B. 属于非金属元素
C. 酸性:H3AsO4﹥H3PO4 D. 稳定性:AsH3﹤PH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课题组为了深入探究二氧化硫的性质设计以下装置进行了实验。
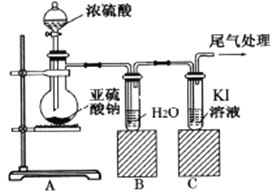
步骤一:检验装置气密性后向B、C中各加入20mL图示液体。
步骤二 :打开A中活塞,反应进行10分钟后关闭活塞。
步骤三:用pH计分别测量B、C 试管中溶液的pH。
结合上述实验,回答以下问题:
(1) 甲同学认为两瓶中pH大致相等,原因是二氧化硫溶于水后生成了酸性物质。该物质发生电离,其电离方程式为___________。
(2) 乙同学认为C瓶中pH可能更小,因为C中二氧化硫会像氧化硫化氢一样与碘离子发生氧化还原反应。通过pH计测定,B瓶中pH为2.13,C瓶中pH为1.05。为了解释该实验现象,该同学提出进行多次平行实验,目的是____________。测定结果如下:
第1次实验 | 第2次实验 | 第3 次实验 | |
B 瓶中pH | 2.15 | 2.10 | 2. 17 |
C 瓶中pH | 1.10 | 1.12 | 1.09 |
实验发现: C瓶中溶液的酸性始终比B瓶中的酸性强。
(3) 通过仔细观察,C瓶中溶液从无色变成浅黄色同时出现黄色浑浊,继续通入气体溶液又逐渐变为无色。其中溶液变黄且出现浑浊的过程对应的离子方程式为________,为了检验产物,中间取出少许溶液加入______,溶液变蓝,证明乙同学判断正确;黄色溶液又逐渐变为无色对应的化学反应方程式为_______________。
(4) 最终结论:
①B瓶中溶液呈弱酸性是由于__________。
②C瓶中溶液呈强酸性是由于生成了_________,该过程中体现出二氧化硫哪些化学性质_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验.
实验I:反应产物的定性探究
按如图装置(固定装置已略去)进行实验
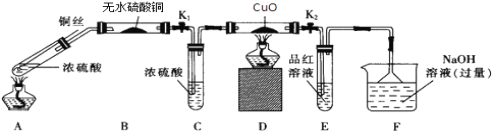
(1)A装置的试管中发生反应的化学方程式是____________;B装置的作用是________E装置中的现象是_______;
(2)实验过程中,能证明无氢气生成的现象是________。
(3)F装置的烧杯中发生反应的离子方程式是_____________________。
实验Ⅱ:反应产物的定量探究
(4)为测定硫酸铜的产率,将该反应所得溶液中和后配制成250.00 mL溶液,取该溶液25.00mL加入足量KI溶液中振荡,生成的I2恰好与20.00 mL 0.30 molL﹣1的Na2S2O3溶液反应,若反应消耗铜的质量为6.4g,则硫酸铜的产率为________。(已知2Cu2++4I﹣=2CuI+I2, 2S2O32﹣+I2=S4O62﹣+2I﹣)(注:硫酸铜的产率指的是硫酸铜的实际产量与理论产量的比值)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质混合后,不会发生离子反应的是 ( )
A.NaOH溶液和FeCl3溶液
B.Na2CO3溶液和稀硫酸
C.Na2SO4溶液和MgCl2溶液
D.澄清的石灰水和盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种因素:①温度和压强、②所含微粒数、③微粒本身大小、④微粒间的距离,其中对气体物质体积有显著影响的是
A.②③④B.②④C.①②④D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用硫铁矿烧渣(主要成分为Fe2O3,还含有少量Al2O3、 MgO、SiO2等杂质)制备铁红工艺流程如下:

回答下列问题:
(1)还原焙烧后,Fe元素的化合价为__________。
(2)“酸浸”实验中,需加入絮凝剂沉淀杂质。絮凝剂用量和过滤时间对铁红成份的影响如下表所示。由表可知,所采用的最佳实验条件为__________(填序号)。
序号 | 絮凝剂用量/×10-6t | 过滤时间/min | Fe2O3含量% | SiO2含量% |
① | 40 | 5 | 96.5 | 0.12 |
② | 50 | 10 | 97.9 | 0.10 |
③ | 60 | 20 | 98.3 | 0.07 |
④ | 100 | 40 | 99.4 | 0.01 |
⑤ | 150 | 150 | 99.5 | 0.008 |
(3)若“合成”中c(Mg2+)=0.01mol/L,加入NH4HCO3(设溶液体积增加1倍),当Fe2+恰好沉淀完全时,溶液中c(Fe2+)=1.0×10-5mol/L,此时是否有MgCO3沉淀生成?__________(列式计算)。FeCO3、MgCO3的Ksp分别为3.2×10-11、3.0×10-8。
(4)“合成”过程中发生反应的离子方程式为_____________。
(5)“合成”过程中温度对亚铁离子转化率的影响如下图,分析选择反应温度为40℃的原因是________。

(6)“煅烧”中由FeCO3制备Fe2O3的化学方程式为________。
(7)本流程中,铝元素是以________(填化学式)形式被除去的。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com