
【题目】某课题组为了深入探究二氧化硫的性质设计以下装置进行了实验。
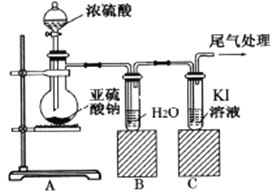
步骤一:检验装置气密性后向B、C中各加入20mL图示液体。
步骤二 :打开A中活塞,反应进行10分钟后关闭活塞。
步骤三:用pH计分别测量B、C 试管中溶液的pH。
结合上述实验,回答以下问题:
(1) 甲同学认为两瓶中pH大致相等,原因是二氧化硫溶于水后生成了酸性物质。该物质发生电离,其电离方程式为___________。
(2) 乙同学认为C瓶中pH可能更小,因为C中二氧化硫会像氧化硫化氢一样与碘离子发生氧化还原反应。通过pH计测定,B瓶中pH为2.13,C瓶中pH为1.05。为了解释该实验现象,该同学提出进行多次平行实验,目的是____________。测定结果如下:
第1次实验 | 第2次实验 | 第3 次实验 | |
B 瓶中pH | 2.15 | 2.10 | 2. 17 |
C 瓶中pH | 1.10 | 1.12 | 1.09 |
实验发现: C瓶中溶液的酸性始终比B瓶中的酸性强。
(3) 通过仔细观察,C瓶中溶液从无色变成浅黄色同时出现黄色浑浊,继续通入气体溶液又逐渐变为无色。其中溶液变黄且出现浑浊的过程对应的离子方程式为________,为了检验产物,中间取出少许溶液加入______,溶液变蓝,证明乙同学判断正确;黄色溶液又逐渐变为无色对应的化学反应方程式为_______________。
(4) 最终结论:
①B瓶中溶液呈弱酸性是由于__________。
②C瓶中溶液呈强酸性是由于生成了_________,该过程中体现出二氧化硫哪些化学性质_____。
【答案】 H2SO3![]() H++HSO3-, HSO3-
H++HSO3-, HSO3-![]() H++SO32- 减小实验误差 SO2+4I-+4H+=S↓+2I2+2H2O 淀粉溶液 SO2+I2+2H2O=H2SO4+2HI 亚硫酸部分电离产生了H+ 硫酸 氧化性和还原性
H++SO32- 减小实验误差 SO2+4I-+4H+=S↓+2I2+2H2O 淀粉溶液 SO2+I2+2H2O=H2SO4+2HI 亚硫酸部分电离产生了H+ 硫酸 氧化性和还原性
【解析】试题分析:(1) 二氧化硫溶于水后生成了亚硫酸,亚硫酸是二元弱酸;(2)进行多次平行实验,目的是进行对比,减小误差;(3) C瓶中溶液从无色变成浅黄色同时出现黄色浑浊,说明二氧化硫与碘离子反应生成碘单质和硫单质;碘能使淀粉变蓝;黄色溶液又逐渐变为无色,说明碘单质被二氧化硫还原为碘离子;(4)B中生成的是亚硫酸,C中生成的是硫酸;二氧化硫生成硫单质,硫元素化合价降低被还原,二氧化硫生成硫酸,硫元素化合价升高被氧化;
解析:(1) 二氧化硫溶于水后生成了亚硫酸,亚硫酸是二元弱酸,电离方程式是H2SO3![]() H++HSO3-, HSO3-
H++HSO3-, HSO3-![]() H++SO32-;(2)进行多次平行实验,目的是减小误差;(3) C瓶中溶液从无色变成浅黄色同时出现黄色浑浊,说明二氧化硫与碘离子反应生成碘单质和硫单质,反应的离子方程式是SO2+4I-+4H+=S↓+2I2+2H2O;碘能使淀粉变蓝,为了检验产物,取出少许溶液加入淀粉溶液,溶液变蓝,证明乙同学判断正确;黄色溶液又逐渐变为无色,说明碘单质被二氧化硫还原为碘离子,化学反应方程式为O2+I2+2H2O=H2SO4+2HI;(4) ①B中生成的是亚硫酸,亚硫酸部分电离产生了H+,所以B瓶中溶液呈弱酸性;C中生成的是硫酸,所以C瓶中溶液呈强酸性;二氧化硫生成硫单质,硫元素化合价降低被还原,二氧化硫生成硫酸,硫元素化合价升高被氧化,体现二氧化硫的氧化性和还原性;
H++SO32-;(2)进行多次平行实验,目的是减小误差;(3) C瓶中溶液从无色变成浅黄色同时出现黄色浑浊,说明二氧化硫与碘离子反应生成碘单质和硫单质,反应的离子方程式是SO2+4I-+4H+=S↓+2I2+2H2O;碘能使淀粉变蓝,为了检验产物,取出少许溶液加入淀粉溶液,溶液变蓝,证明乙同学判断正确;黄色溶液又逐渐变为无色,说明碘单质被二氧化硫还原为碘离子,化学反应方程式为O2+I2+2H2O=H2SO4+2HI;(4) ①B中生成的是亚硫酸,亚硫酸部分电离产生了H+,所以B瓶中溶液呈弱酸性;C中生成的是硫酸,所以C瓶中溶液呈强酸性;二氧化硫生成硫单质,硫元素化合价降低被还原,二氧化硫生成硫酸,硫元素化合价升高被氧化,体现二氧化硫的氧化性和还原性;


科目:高中化学 来源: 题型:
【题目】若把周期表原先的主、副族序号取消,由左到右按原顺序编为18列。如碱金属为第一列稀有气体为第18列,按这个规定,下列说法中不正确的是
A.第10列元素全部是金属元素
B.第18列元素单质全部是气体
C.只有第2列元素的原子最外层有2个电子
D.第3列元素种类数最多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
实验编号 | HA物质的量浓度 | NaOH物质的量浓度 | 混合溶液的pH |
甲 | 0.2 | 0.2 | pH=a |
乙 | c | 0.2 | pH=7 |
丙 | 0.2 | 0.1 | pH>7 |
丁 | 0.1 | 0.1 | pH=9 |
(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)来说明HA是强酸还是弱酸 .
(2)不考虑其它组的实验结果,单从乙组情况分析,C是否一定等于0.2(选填“是”或“否”).混合液中离子浓度c(A﹣)与 c(Na+)的大小关系是 .
(3)丙组实验结果分析,HA是酸(选填“强”或“弱”).该混合溶液中离子浓度由大到小的顺序是 .
(4)丁组实验所得混合溶液中由水电离出的c(OH﹣)=molL﹣1 . 写出该混合溶液中下列算式的精确结果(不需做近似计算).c(Na+)﹣c(A﹣)=molL﹣1 c(OH﹣)﹣c(HA)=molL﹣1 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钨是熔点最高的金属,也是重要的战略物资。自然界中钨矿石主要有黑钨矿和白钨矿两种。其中,黑钨矿主要成分是铁和锰的钨酸盐(FeWO4、MnWO4) 以及少量杂质(含Si、P、As元素的化合物)。由黑钨矿冶炼钨的“黑钨精矿高压碱煮(烧破)一溶剂萃取一蒸发结晶法”工艺流程如下图:

回答下列问题:
(1) 高压碱煮法中,“高压”的目的是_____________。
(2) 滤渣1的主要成分中含有的金属元素为_______。
(3) 除最后 一步外,流程中钨元素价态均未发生改变,则FeWO4中铁元素的价态为_____。第一步黑钨矿原料熔融时,FeWO4发生反应的化学方程式为________。
(4) H2SO4中和后溶液中还有SiO32-、AsO33-、AsO43-、PO43-等离子,则加入H2O2时发生反 应的离子方程式为_________。
(5) 钨酸钠溶液还含有NaOH、NaCl 和_____杂质。为了得到纯净的钨酸,需要经过萃取和反萃取工业流程。该操作中使用到的玻璃仪器有_________。 向钨酸钠溶液中加入四辛基氧化铵有机萃取剂萃取分液,此时钨元素处于_____层中(填“有机”或“无机”)。然后加入氨水反萃取、结晶得到仲钨酸铵(NH4)6W7O2·7H2O,仲钨酸铵加热分解得到三氧化钨的化学方程式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知元素A、B、C均为前三周期的元素,其中A、B同主族,B是其同周期中原子半径最大的元素。C与A、B均不在同一周期,且与C同主族的某金属的氧化物具有两性。请回答:
(1)A、B、C 三种元素中第一电离能最小的元素是______ (填元素符号),其基态原子核外电子排布为______________。
(2)C元素的单质可与Cl2反应生成CCl3,该分子为_____结构,是_____(填“极性分子”“非极性分子”),与水反应剧烈产生“白烟”,其方程式为______________。
(3)A、B两种元素可形成化合物X,写出X的电子式_______。
(4)A、C两种元素可形成化合物Y(C2A6),其中心原子的杂化方式为_______。
(5)A、.B、C三种元素组成的化合物Z(分子式为BCA4),该物质曾作为一种还原剂,这是由于A 的价态为__________。
(6)Z形成的晶体属于立方晶系,晶胞参数为apm,其晶体类型为______,晶胞如下图所示(图中A原子被省略),在此晶胞中,含有_____个B原子。晶胞密度表达式为____ g·cm-3 (用a和NA表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.现有三种短周期元素:①H ②Na ③Cl。
(1)氢原子结构示意图______; ②的单质在③的单质中燃烧,生成物是一种_______化合物(填“离子”或“共价”)。
(2)①与③形成的化合物的电子式是_______________,该化合物中含有___________共价键(填“极性”或“非极性”)。
Ⅱ.现有四种烃分子的球棍模型(如图)。
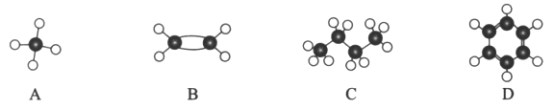
(1)与A互为同系物的是___________(填序号)。
(2)能使酸性高锰酸钾溶液褪色的物质是_____________(填序号)。
(3)C的同分异构体的结构简式是_____________________________。
(4)在光照条件下,A与氯气发生反应生成气态有机物的化学反应方程式是:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为V L的密闭容器中通入a mol NO和b mol O2 , 发生如下反应:2NO+O2═2NO2 , 反应后容器内氮原子和氧原子数之比是( )
A.a:b
B.a:2b
C.a:(2a+2b)
D.a:(a+2b)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A是石油裂解气的主要产物之一,其产量是衡量一个国家石油化工发展水平的标志。下列是有机物A~G之间的转化关系:
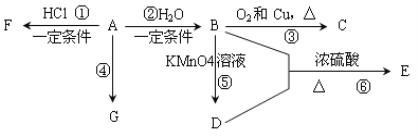
请回答下列问题:
(1)A、D中所含官能团的名称分别是_______________;C的结构简式是_____________;
(2)E是一种具有香味的液体,由B + D→E的反应方程式为:______________,反应类型是________。
(3)G是一种高分子化合物,其结构简式是____________________________________;
(4)俄罗斯足球世界杯激战正酣,在比赛中当运动员肌肉扭伤时,队医立即对其受伤部位喷射物质F进行应急处理。写出由A制F的化学反应方程式:___________。
(5)H是E的同分异构体,且H能与NaHCO3反应,则H的结构简式可能为(写出2种):_____________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,往HA溶液中滴加NaOH溶液,溶液中HA和A-二者中各自所占的物质的量分数(α)随溶液pH变化的关系如图所示。下列说法正确的是
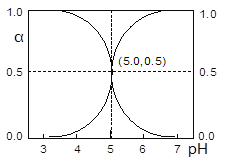
A. 在pH=5.0的溶液中,c(A-)=c(HA),c(OH-)= c(H+)
B. pH=7的溶液中,α(HA)=0,α(A-)=1.0
C. 25℃时,Ka(HA)=1×10-5
D. pH=5.0时,溶液中水电离产生的c(H+)=1×10-5mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com