
【题目】已知:A是石油裂解气的主要产物之一,其产量是衡量一个国家石油化工发展水平的标志。下列是有机物A~G之间的转化关系:
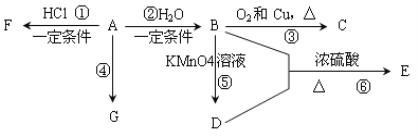
请回答下列问题:
(1)A、D中所含官能团的名称分别是_______________;C的结构简式是_____________;
(2)E是一种具有香味的液体,由B + D→E的反应方程式为:______________,反应类型是________。
(3)G是一种高分子化合物,其结构简式是____________________________________;
(4)俄罗斯足球世界杯激战正酣,在比赛中当运动员肌肉扭伤时,队医立即对其受伤部位喷射物质F进行应急处理。写出由A制F的化学反应方程式:___________。
(5)H是E的同分异构体,且H能与NaHCO3反应,则H的结构简式可能为(写出2种):_____________________________________________________________________。
【答案】 碳碳双键 羧基 CH3CHO CH3COOH + CH3CH2OH![]() CH3COOCH2CH3 + H2O 取代反应或酯化反应
CH3COOCH2CH3 + H2O 取代反应或酯化反应 ![]() CH2=CH2 + HCl
CH2=CH2 + HCl ![]() CH3CH2Cl CH3 CH2 CH2COOH 、(CH3)2 CHCOOH
CH3CH2Cl CH3 CH2 CH2COOH 、(CH3)2 CHCOOH
【解析】A是石油裂解气的主要产物之一,其产量是衡量一个国家石油化工发展水平的标志,说明A为乙烯,则根据转化关系分析,B为乙醇,C为乙醛,D为乙酸,E为乙酸乙酯,F为氯乙烷,G为聚乙烯。(1)根据以上分析可知,乙烯的官能团为碳碳双键,D的官能团为羧基;C为乙醛,结构简式为:CH3CHO;(2)E是乙酸乙酯,乙酸和乙醇在浓硫酸加热的条件下生成的,方程式为:CH3COOH + CH3CH2OH![]() CH3COOCH2CH3 + H2O,该反应类型为取代反应或酯化反应;(3)G为聚乙烯,结构简式为:
CH3COOCH2CH3 + H2O,该反应类型为取代反应或酯化反应;(3)G为聚乙烯,结构简式为: ![]() ; (4) 乙烯和氯化氢反应生成氯乙烷,方程式为:CH2=CH2 + HCl
; (4) 乙烯和氯化氢反应生成氯乙烷,方程式为:CH2=CH2 + HCl ![]() CH3CH2Cl; (5)H是E乙酸乙酯的同分异构体,能与碳酸氢钠反应,说明其含有羧基,所以可能的结构简式为:CH3CH2CH2COOH、(CH3)2 CHCOOH。
CH3CH2Cl; (5)H是E乙酸乙酯的同分异构体,能与碳酸氢钠反应,说明其含有羧基,所以可能的结构简式为:CH3CH2CH2COOH、(CH3)2 CHCOOH。


科目:高中化学 来源: 题型:
【题目】已知下列氧化剂均能氧化+4价的硫元素,为了除去稀硫酸中混有的亚硫酸,应选用的最合理的氧化剂是( )
A.KMnO4
B.Ca(ClO)2
C.Cl2
D.H2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课题组为了深入探究二氧化硫的性质设计以下装置进行了实验。
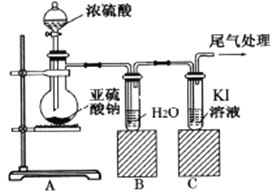
步骤一:检验装置气密性后向B、C中各加入20mL图示液体。
步骤二 :打开A中活塞,反应进行10分钟后关闭活塞。
步骤三:用pH计分别测量B、C 试管中溶液的pH。
结合上述实验,回答以下问题:
(1) 甲同学认为两瓶中pH大致相等,原因是二氧化硫溶于水后生成了酸性物质。该物质发生电离,其电离方程式为___________。
(2) 乙同学认为C瓶中pH可能更小,因为C中二氧化硫会像氧化硫化氢一样与碘离子发生氧化还原反应。通过pH计测定,B瓶中pH为2.13,C瓶中pH为1.05。为了解释该实验现象,该同学提出进行多次平行实验,目的是____________。测定结果如下:
第1次实验 | 第2次实验 | 第3 次实验 | |
B 瓶中pH | 2.15 | 2.10 | 2. 17 |
C 瓶中pH | 1.10 | 1.12 | 1.09 |
实验发现: C瓶中溶液的酸性始终比B瓶中的酸性强。
(3) 通过仔细观察,C瓶中溶液从无色变成浅黄色同时出现黄色浑浊,继续通入气体溶液又逐渐变为无色。其中溶液变黄且出现浑浊的过程对应的离子方程式为________,为了检验产物,中间取出少许溶液加入______,溶液变蓝,证明乙同学判断正确;黄色溶液又逐渐变为无色对应的化学反应方程式为_______________。
(4) 最终结论:
①B瓶中溶液呈弱酸性是由于__________。
②C瓶中溶液呈强酸性是由于生成了_________,该过程中体现出二氧化硫哪些化学性质_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验.
实验I:反应产物的定性探究
按如图装置(固定装置已略去)进行实验
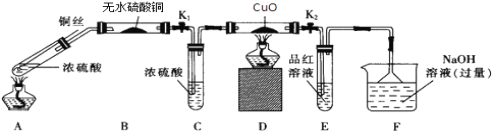
(1)A装置的试管中发生反应的化学方程式是____________;B装置的作用是________E装置中的现象是_______;
(2)实验过程中,能证明无氢气生成的现象是________。
(3)F装置的烧杯中发生反应的离子方程式是_____________________。
实验Ⅱ:反应产物的定量探究
(4)为测定硫酸铜的产率,将该反应所得溶液中和后配制成250.00 mL溶液,取该溶液25.00mL加入足量KI溶液中振荡,生成的I2恰好与20.00 mL 0.30 molL﹣1的Na2S2O3溶液反应,若反应消耗铜的质量为6.4g,则硫酸铜的产率为________。(已知2Cu2++4I﹣=2CuI+I2, 2S2O32﹣+I2=S4O62﹣+2I﹣)(注:硫酸铜的产率指的是硫酸铜的实际产量与理论产量的比值)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质混合后,不会发生离子反应的是 ( )
A.NaOH溶液和FeCl3溶液
B.Na2CO3溶液和稀硫酸
C.Na2SO4溶液和MgCl2溶液
D.澄清的石灰水和盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学是以实验为基础的.利用已学知识对下列实验进行分析并填空:
Ⅰ.某研究性学习小组设计了一组实验来探究元素周期律.
甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置完成同主族元素C、Si非金属性强弱比较的实验研究;
乙同学设计了如图2装置实验来验证卤族元素性质的递变规律(夹持装置已略去).A、B、C三个胶头滴管分别是氯酸钾溶液、NaBr溶液、淀粉KI溶液.已知常温下浓盐酸与氯酸钾溶液能反应生成氯气.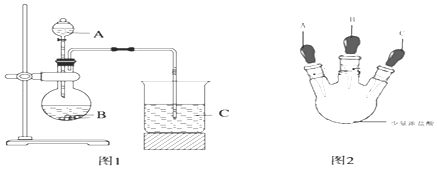
(1)甲同学设计实验所涉及的离子方程为:、 .
(2)乙同学具体操作如下:
①先挤压胶头滴管A,使少量溶液滴入烧瓶内;
②挤压胶头滴管B,使稍过量溶液滴入烧瓶内,充分反应.写出该操作中主要离子方程式为 .
③再挤压胶头滴管C,使少量溶液滴入烧瓶内,可观察到;
(3)根据甲乙同学的实验可得到的结论是:
(4)II.
实验 |
| ||
实验 |
|
|
|
实验 | 结论: | ||
反应 | |||
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种因素:①温度和压强、②所含微粒数、③微粒本身大小、④微粒间的距离,其中对气体物质体积有显著影响的是
A.②③④B.②④C.①②④D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 大米富含淀粉
B. 加碘食盐含有碘酸钾(KIO3)
C. 人体必需的微量元素就是维生素
D. 人体必需的微量元素不都是金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学式中,正确的是( )
A.甲烷的燃烧热为 890.3 kJmol﹣1 , 则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=﹣890.3 kJmol﹣1
B.500℃、30MPa 下,将 0.5mol N2和 1.5molH2置于密闭容器中充分反应生成 NH3(g),放热 19.3 kJ,其热化学方程式为:N2+3H2(g) ![]() 2NH3(g)△H=﹣38.6 kJmol﹣1
2NH3(g)△H=﹣38.6 kJmol﹣1
C.稀盐酸和 稀氢氧化钠溶液混合,其热化学方程式为:H+(aq)+OH﹣(aq)=H2O(l)△H=﹣57.3 kJmol﹣1
D.1molH2完全燃烧放热 142.9kJ,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l)△H=+285.8 kJmol﹣1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com