
【题目】钨是熔点最高的金属,也是重要的战略物资。自然界中钨矿石主要有黑钨矿和白钨矿两种。其中,黑钨矿主要成分是铁和锰的钨酸盐(FeWO4、MnWO4) 以及少量杂质(含Si、P、As元素的化合物)。由黑钨矿冶炼钨的“黑钨精矿高压碱煮(烧破)一溶剂萃取一蒸发结晶法”工艺流程如下图:

回答下列问题:
(1) 高压碱煮法中,“高压”的目的是_____________。
(2) 滤渣1的主要成分中含有的金属元素为_______。
(3) 除最后 一步外,流程中钨元素价态均未发生改变,则FeWO4中铁元素的价态为_____。第一步黑钨矿原料熔融时,FeWO4发生反应的化学方程式为________。
(4) H2SO4中和后溶液中还有SiO32-、AsO33-、AsO43-、PO43-等离子,则加入H2O2时发生反 应的离子方程式为_________。
(5) 钨酸钠溶液还含有NaOH、NaCl 和_____杂质。为了得到纯净的钨酸,需要经过萃取和反萃取工业流程。该操作中使用到的玻璃仪器有_________。 向钨酸钠溶液中加入四辛基氧化铵有机萃取剂萃取分液,此时钨元素处于_____层中(填“有机”或“无机”)。然后加入氨水反萃取、结晶得到仲钨酸铵(NH4)6W7O2·7H2O,仲钨酸铵加热分解得到三氧化钨的化学方程式为_________________________。
【答案】 增大氧气的浓度,提高反应速率 Fe、 Mn。 +2 4FeWO4+8NaOH+O2![]() 4Na2WO4+2Fe2O3+4H2O(无加热符号不扣分) AsO33-+H2O2=AsO43-+H2O Na2SO4 分液漏斗、烧杯 有机 (NH4)6W7O24·7H2O
4Na2WO4+2Fe2O3+4H2O(无加热符号不扣分) AsO33-+H2O2=AsO43-+H2O Na2SO4 分液漏斗、烧杯 有机 (NH4)6W7O24·7H2O![]() 6NH3↑+ 7WO3 + 10H2O
6NH3↑+ 7WO3 + 10H2O
【解析】试题分析:(1)氧气是反应物,增大压强可以提高反应速率;(2)黑钨矿主要成分是铁和锰的钨酸盐,高压碱煮,过滤后的溶液中含有钨酸钠,不含Fe、 Mn元素;(3) 钨酸钠中W元素的化合价是+6,根据化合价代数和等于0计算FeWO4中Fe元素的化合价; FeWO4与NaOH、O2加热熔融生成Na2WO4、Fe2O3;(4) 根据流程图,加入H2O2时AsO33-被氧化为AsO43-;(5)根据流程图,钨酸钠溶液中含有硫酸根离子;萃取分液用到的玻璃仪器是分液漏斗、烧杯;向钨酸钠溶液中加入四辛基氧化铵有机萃取剂萃取分液,钨元素处于有机层;仲钨酸铵分解生成NH3、WO3 、H2O;
解析:(1)高压碱煮法中,氧气是反应物,“高压”的目的是增大氧气的浓度,提高反应速率;(2)黑钨矿主要成分是铁和锰的钨酸盐,高压碱煮,过滤后的溶液是钨酸钠,不含Fe、 Mn元素,所以滤渣1的主要成分中含有的金属元素为Fe、 Mn;(3) 钨酸钠中W元素的化合价是+6,根据化合价代数和等于0,FeWO4中Fe元素的化合价为+2;FeWO4与NaOH、O2加热熔融生成Na2WO4、Fe2O3,反应方程式是4FeWO4+8NaOH+O2![]() 4Na2WO4+2Fe2O3+4H2O;(4) 根据流程图,加入H2O2时AsO33-被氧化为AsO43-,反应的话离子方程式是AsO33-+H2O2=AsO43-+H2O;(5)根据流程图,钨酸钠溶液中含有硫酸根离子,所以钨酸钠溶液还含有NaOH、NaCl和Na2SO4杂质;萃取分液用到的玻璃仪器是分液漏斗、烧杯;根据题意,向钨酸钠溶液中加入四辛基氧化铵有机萃取剂萃取分液,钨元素处于有机层;仲钨酸铵分解生成WO3 的方程式是(NH4)6W7O24·7H2O
4Na2WO4+2Fe2O3+4H2O;(4) 根据流程图,加入H2O2时AsO33-被氧化为AsO43-,反应的话离子方程式是AsO33-+H2O2=AsO43-+H2O;(5)根据流程图,钨酸钠溶液中含有硫酸根离子,所以钨酸钠溶液还含有NaOH、NaCl和Na2SO4杂质;萃取分液用到的玻璃仪器是分液漏斗、烧杯;根据题意,向钨酸钠溶液中加入四辛基氧化铵有机萃取剂萃取分液,钨元素处于有机层;仲钨酸铵分解生成WO3 的方程式是(NH4)6W7O24·7H2O![]() 6NH3↑+ 7WO3 + 10H2O;
6NH3↑+ 7WO3 + 10H2O;


科目:高中化学 来源: 题型:
【题目】绿矾(FeSO4·nH2O)在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。请回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化;再向试管中通入空气,溶液逐渐变红。请解释变红的原因________________________。
(2)为测定某绿矾中结晶水含量,按下图组装好仪器并检查气密性。将石英玻璃管(带两端开关K1和K2)(设整个为装置A)称重,记为80.120g。将样品装入石英玻璃管中,再次将装置A称重,记为 107.020g。按下图连接好装置进行实验。
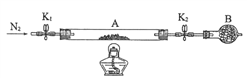
①仪器B的名称是____________________。
②实验操作步骤为: 第一步: 打开K1和K2,缓缓通入N2 ; 第二步:点燃酒精灯,小心加热;第三步:熄灭酒精灯 ;第四步:冷却到室温 ; 第五步:关闭K1和K2 ; 第六步:称量A 。 请问: 第一步缓缓通入N2 的目的是________________________。
重复上述操作步骤,直至A恒重,记为95.320g。
③计算绿矾化学式中结晶水n=________________(保留一位小数)。
(3)同学们查找资料可知,硫酸亚铁在高温下分解产物为Fe2O3 以及 SO2和SO3。为了验证硫酸亚铁分解的气体产物,将已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加强热充分反应后,管中残留固体为 _______ 色粉末。![]()
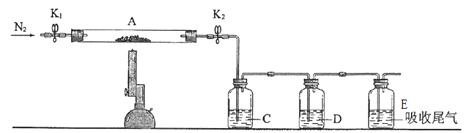
C、D中的溶液依次为________ 、________(填标号)。
a.品红 b.NaOH c.BaCl2 d.浓硫酸
(4)“严谨不仅仅是一种生活态度,更是科学精神”。检查装置气密性是化学实验中的重要操作之一,在上述32题实验装置气密性检查的操作是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列氧化剂均能氧化+4价的硫元素,为了除去稀硫酸中混有的亚硫酸,应选用的最合理的氧化剂是( )
A.KMnO4
B.Ca(ClO)2
C.Cl2
D.H2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香烟烟雾中往往含有CO和SO2气体,下列关于这两种气体的说法正确的是( )
A.两者都易溶于水
B.两者都污染环境,危害健康
C.两者都能使品红溶液褪色
D.两者都是形成酸雨的主要原因
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】As的原子结构示意图为![]() ,下列关于As的描述不正确的是 ( )
,下列关于As的描述不正确的是 ( )
A. 位于第四周期,第ⅤA族 B. 属于非金属元素
C. 酸性:H3AsO4﹥H3PO4 D. 稳定性:AsH3﹤PH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是人类从海水资源中提取某些重要化工原料的流程示意图:
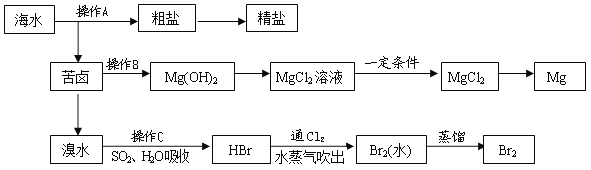
请回答下列问题:
(1)操作A是__________________和过滤(填实验基本操作名称)
(2)操作B需加入下列试剂中的一种,最合适的是________(选填编号)
A. 氢氧化钠溶液 B. 澄清石灰水
C. 石灰乳 D. 碳酸钠溶液
(3)向苦卤中通入Cl2,发生反应的离子方程式是_____________________,用SO2水溶液吸收Br2 ,吸收率可达95%,有关反应的离子方程式为___________________。
(4)工业上由无水MgCl2制取镁的化学方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课题组为了深入探究二氧化硫的性质设计以下装置进行了实验。
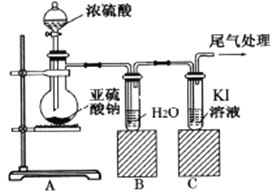
步骤一:检验装置气密性后向B、C中各加入20mL图示液体。
步骤二 :打开A中活塞,反应进行10分钟后关闭活塞。
步骤三:用pH计分别测量B、C 试管中溶液的pH。
结合上述实验,回答以下问题:
(1) 甲同学认为两瓶中pH大致相等,原因是二氧化硫溶于水后生成了酸性物质。该物质发生电离,其电离方程式为___________。
(2) 乙同学认为C瓶中pH可能更小,因为C中二氧化硫会像氧化硫化氢一样与碘离子发生氧化还原反应。通过pH计测定,B瓶中pH为2.13,C瓶中pH为1.05。为了解释该实验现象,该同学提出进行多次平行实验,目的是____________。测定结果如下:
第1次实验 | 第2次实验 | 第3 次实验 | |
B 瓶中pH | 2.15 | 2.10 | 2. 17 |
C 瓶中pH | 1.10 | 1.12 | 1.09 |
实验发现: C瓶中溶液的酸性始终比B瓶中的酸性强。
(3) 通过仔细观察,C瓶中溶液从无色变成浅黄色同时出现黄色浑浊,继续通入气体溶液又逐渐变为无色。其中溶液变黄且出现浑浊的过程对应的离子方程式为________,为了检验产物,中间取出少许溶液加入______,溶液变蓝,证明乙同学判断正确;黄色溶液又逐渐变为无色对应的化学反应方程式为_______________。
(4) 最终结论:
①B瓶中溶液呈弱酸性是由于__________。
②C瓶中溶液呈强酸性是由于生成了_________,该过程中体现出二氧化硫哪些化学性质_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验.
实验I:反应产物的定性探究
按如图装置(固定装置已略去)进行实验
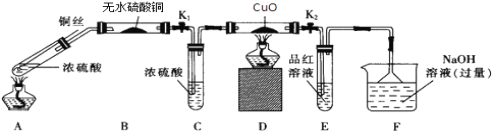
(1)A装置的试管中发生反应的化学方程式是____________;B装置的作用是________E装置中的现象是_______;
(2)实验过程中,能证明无氢气生成的现象是________。
(3)F装置的烧杯中发生反应的离子方程式是_____________________。
实验Ⅱ:反应产物的定量探究
(4)为测定硫酸铜的产率,将该反应所得溶液中和后配制成250.00 mL溶液,取该溶液25.00mL加入足量KI溶液中振荡,生成的I2恰好与20.00 mL 0.30 molL﹣1的Na2S2O3溶液反应,若反应消耗铜的质量为6.4g,则硫酸铜的产率为________。(已知2Cu2++4I﹣=2CuI+I2, 2S2O32﹣+I2=S4O62﹣+2I﹣)(注:硫酸铜的产率指的是硫酸铜的实际产量与理论产量的比值)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 大米富含淀粉
B. 加碘食盐含有碘酸钾(KIO3)
C. 人体必需的微量元素就是维生素
D. 人体必需的微量元素不都是金属元素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com