
【题目】如图是人类从海水资源中提取某些重要化工原料的流程示意图:
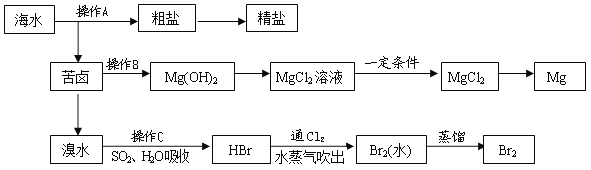
请回答下列问题:
(1)操作A是__________________和过滤(填实验基本操作名称)
(2)操作B需加入下列试剂中的一种,最合适的是________(选填编号)
A. 氢氧化钠溶液 B. 澄清石灰水
C. 石灰乳 D. 碳酸钠溶液
(3)向苦卤中通入Cl2,发生反应的离子方程式是_____________________,用SO2水溶液吸收Br2 ,吸收率可达95%,有关反应的离子方程式为___________________。
(4)工业上由无水MgCl2制取镁的化学方程式为____________________。
【答案】 蒸发结晶 c Cl2+2Br-=Br2+2Cl- Br2+SO2+2H2O=4H++SO42﹣+2Br- MgCl2(熔融)![]() Mg+Cl2↑
Mg+Cl2↑
【解析】海水晒盐过滤得到苦卤和粗盐,粗盐精制得到饱和食盐水,苦卤中加入石灰乳沉淀镁离子形成氢氧化镁沉淀,过滤得到氢氧化镁沉淀中加入盐酸溶解得到氯化镁溶液,蒸发浓缩,冷却结晶得到氯化镁晶体,在氯化氢气流中加热得到氯化镁,电解熔融氯化镁得到金属镁;苦卤中通入氯气氧化溴离子为单质溴,用二氧化硫水溶液吸收溴单质,得到HBr,再通入氯气氧化溴化氢得到溴单质,富集溴元素,用水蒸气吹出蒸馏得到液溴,据此解答。
(1)食盐的溶解度受温度变化影响较小,可以通过蒸发结晶的方法得到氯化钠;
(2)工业制镁:把海边的贝壳制成生石灰:CaCO3![]() CaO+CO2↑,在海水中加入生石灰:CaO+H2O=Ca(OH)2,在引入的海水中加入石灰乳,发生反应:MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2,这样原料的成本低,且能将镁离子全部沉淀下来,所以最合适的是石灰乳,答案选c;
CaO+CO2↑,在海水中加入生石灰:CaO+H2O=Ca(OH)2,在引入的海水中加入石灰乳,发生反应:MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2,这样原料的成本低,且能将镁离子全部沉淀下来,所以最合适的是石灰乳,答案选c;
(3)氯气氧化溴离子得到单质溴,离子方程式为:Cl2+2Br-=Br2+2Cl-;用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为Br2+SO2+2H2O=4H++SO42﹣+2Br-;
(4)工业上由无水MgCl2制取镁的化学方程式为MgCl2(熔融)![]() Mg+Cl2↑。
Mg+Cl2↑。


科目:高中化学 来源: 题型:
【题目】常温常压下,在带有相同质量活塞的容积相等的甲、乙两容器里,分别充有二氧化氮和空气,现分别进行下列两个实验:(N2O42NO2△H>0)
(a)将两容器置于沸水中加热
(b)在活塞上都加2kg的砝码
在以上两情况下,甲和乙容器的体积大小的比较,正确的是( )
A.(a)甲>乙,(b)甲>乙
B.(a)甲>乙,(b)甲=乙
C.(a)甲<乙,(b)甲>乙
D.(a)甲>乙,(b)甲<乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在通常情况下能大量共存,并且可以用浓硫酸干燥的一组气体是( )
A.SO2、H2S、O2
B.CO、H2、Cl2
C.NO、H2、O2
D.HCl、CO、NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某课外活动小组设计的用化学电池使LED灯发光的装置。下列说法错误的是( )
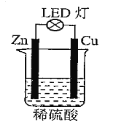
A. 正极反应为:Zn-2e-=Zn2+
B. 装置中存在”化学能→电能→光能”的转换
C. Zn为负极,Cu为正极
D. 铜表面有气泡生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钨是熔点最高的金属,也是重要的战略物资。自然界中钨矿石主要有黑钨矿和白钨矿两种。其中,黑钨矿主要成分是铁和锰的钨酸盐(FeWO4、MnWO4) 以及少量杂质(含Si、P、As元素的化合物)。由黑钨矿冶炼钨的“黑钨精矿高压碱煮(烧破)一溶剂萃取一蒸发结晶法”工艺流程如下图:

回答下列问题:
(1) 高压碱煮法中,“高压”的目的是_____________。
(2) 滤渣1的主要成分中含有的金属元素为_______。
(3) 除最后 一步外,流程中钨元素价态均未发生改变,则FeWO4中铁元素的价态为_____。第一步黑钨矿原料熔融时,FeWO4发生反应的化学方程式为________。
(4) H2SO4中和后溶液中还有SiO32-、AsO33-、AsO43-、PO43-等离子,则加入H2O2时发生反 应的离子方程式为_________。
(5) 钨酸钠溶液还含有NaOH、NaCl 和_____杂质。为了得到纯净的钨酸,需要经过萃取和反萃取工业流程。该操作中使用到的玻璃仪器有_________。 向钨酸钠溶液中加入四辛基氧化铵有机萃取剂萃取分液,此时钨元素处于_____层中(填“有机”或“无机”)。然后加入氨水反萃取、结晶得到仲钨酸铵(NH4)6W7O2·7H2O,仲钨酸铵加热分解得到三氧化钨的化学方程式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学-选修5:有机化学基础】
尼龙-6(聚-6-氨基已酸)和尼龙-66(聚己二酸己二胺) 是两种常用的有机高分子纤维,是目前世界上应用最广、产量最大、性能优良的合成纤维。其合成路线如下:
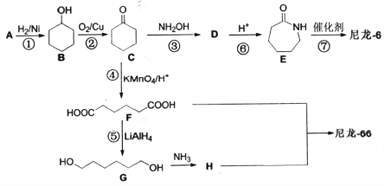
已知:a.A是一种常见的酸性工业原料b. 
请回答以下问题:
(1)C与H中所含的官能团名称分别为_______、_______。
(2)A的结构简式为___________。
(3)合成路线中与D互为同分异构体的化合物是____(填写分子代号),与第②步的反应类型相同的反应步骤是___。
(4)合成尼龙-66的化学反应方程式为________ 。
(5)写出F的同分异构体中所有满足下列条件的物质的结构简式_______。
a.能发生水解反应,且1mol该物质能与2mol银氨溶液发生银镜反应;
b.能与碳酸氢钠溶液反应产生气泡;
c.核磁共振氢谱显示4组峰,氢原子个数比为1:1:2:6。
(6)因为分子结构中含有-NH2,这两种尼龙作为纺织材料时经常采用_____进行印染。(填“酸性染料“或“碱性染料”)
(7)结合上述合成路线,由已知化合物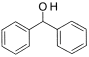 设计路线合成
设计路线合成 (其余小分子原料自选)。
(其余小分子原料自选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.现有三种短周期元素:①H ②Na ③Cl。
(1)氢原子结构示意图______; ②的单质在③的单质中燃烧,生成物是一种_______化合物(填“离子”或“共价”)。
(2)①与③形成的化合物的电子式是_______________,该化合物中含有___________共价键(填“极性”或“非极性”)。
Ⅱ.现有四种烃分子的球棍模型(如图)。
(1)与A互为同系物的是___________(填序号)。
(2)能使酸性高锰酸钾溶液褪色的物质是_____________(填序号)。
(3)C的同分异构体的结构简式是_____________________________。
(4)在光照条件下,A与氯气发生反应生成气态有机物的化学反应方程式是:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566.0 kJ·mol-1;键能EO=O=499.0 kJ·mol-1则CO(g)+O2(g)CO2(g)+O(g)的ΔH=______kJ·mol-1。
Ⅱ.汽车尾气净化的主要反应原理为2NO(g)+2CO(g)2CO2(g)+N2(g)。将1.0 mol NO、0.8 mol CO充入2 L恒容密闭容器,分别在T1℃和T2℃下测得n(CO2)随时间(t)的变化曲线如下图所示。

(1)T2℃时,0~2s内的平均反应速率v(N2)= ________。
(2)该反应自发进行的条件(假设ΔH,ΔS不随温度变化而变化)___(高温自发,低温自发,任何温度均不自发,任何温度均自发)。
(3)为使该反应的反应速度增大,且平衡向正反方向移动的是________。
A.及时分离除CO2气体 B.适当升高温度
C.增大CO的浓度 D.选择高效催化剂
Ⅲ .工业可以采用下列反应合成甲醇:CO(g)+2H2(g) CH3OH(g),在一体积可变的密闭容器中(如图),将2 mol CO和3 mol H2放入容器中,移动活塞至体积为V L,用铆钉固定在A、B点,发生反应,测得在不同条件,不同时段内CO的转化率,得出下列数据。
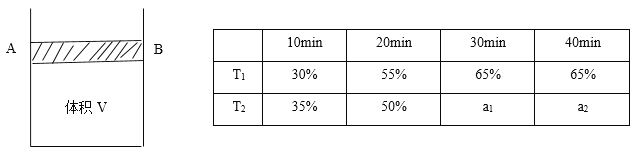
(1)根据上表数据,比较T1_______T2(选填“>、=、<”);T2温度下,第20 min时,反应达到平衡,该温度下的平衡常数为__________。
(2)T2温度下,第40 min时,拔出铆钉后,活塞没有发生移动,再向容器中通入6 mol的CO,此时V(正)________V(逆) (选填“>、=、<”),判断理由是:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.聚合物 ![]() 可由单体CH3CH=CH2和CH2=CH2加聚制得
可由单体CH3CH=CH2和CH2=CH2加聚制得
B.1 molCH3COOH与1mol CH3CH2OH在浓硫酸共热下生成的乙酸乙酯分子数为NA
C.乙醇、苯酚、乙酸都有羟基,但是羟基上的H活泼性不同,主要是基团之间相互影响造成的
D.等物质的量的乙炔和乙醛分别充分燃烧,所耗用氧气的量相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com