
【题目】25℃时,往HA溶液中滴加NaOH溶液,溶液中HA和A-二者中各自所占的物质的量分数(α)随溶液pH变化的关系如图所示。下列说法正确的是
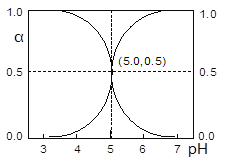
A. 在pH=5.0的溶液中,c(A-)=c(HA),c(OH-)= c(H+)
B. pH=7的溶液中,α(HA)=0,α(A-)=1.0
C. 25℃时,Ka(HA)=1×10-5
D. pH=5.0时,溶液中水电离产生的c(H+)=1×10-5mol·L-1
科目:高中化学 来源: 题型:
【题目】某课题组为了深入探究二氧化硫的性质设计以下装置进行了实验。
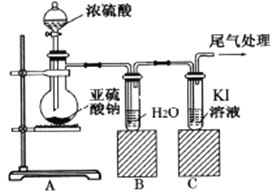
步骤一:检验装置气密性后向B、C中各加入20mL图示液体。
步骤二 :打开A中活塞,反应进行10分钟后关闭活塞。
步骤三:用pH计分别测量B、C 试管中溶液的pH。
结合上述实验,回答以下问题:
(1) 甲同学认为两瓶中pH大致相等,原因是二氧化硫溶于水后生成了酸性物质。该物质发生电离,其电离方程式为___________。
(2) 乙同学认为C瓶中pH可能更小,因为C中二氧化硫会像氧化硫化氢一样与碘离子发生氧化还原反应。通过pH计测定,B瓶中pH为2.13,C瓶中pH为1.05。为了解释该实验现象,该同学提出进行多次平行实验,目的是____________。测定结果如下:
第1次实验 | 第2次实验 | 第3 次实验 | |
B 瓶中pH | 2.15 | 2.10 | 2. 17 |
C 瓶中pH | 1.10 | 1.12 | 1.09 |
实验发现: C瓶中溶液的酸性始终比B瓶中的酸性强。
(3) 通过仔细观察,C瓶中溶液从无色变成浅黄色同时出现黄色浑浊,继续通入气体溶液又逐渐变为无色。其中溶液变黄且出现浑浊的过程对应的离子方程式为________,为了检验产物,中间取出少许溶液加入______,溶液变蓝,证明乙同学判断正确;黄色溶液又逐渐变为无色对应的化学反应方程式为_______________。
(4) 最终结论:
①B瓶中溶液呈弱酸性是由于__________。
②C瓶中溶液呈强酸性是由于生成了_________,该过程中体现出二氧化硫哪些化学性质_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种因素:①温度和压强、②所含微粒数、③微粒本身大小、④微粒间的距离,其中对气体物质体积有显著影响的是
A.②③④B.②④C.①②④D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 大米富含淀粉
B. 加碘食盐含有碘酸钾(KIO3)
C. 人体必需的微量元素就是维生素
D. 人体必需的微量元素不都是金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应A+B=C+D是放热反应,对该反应的说法正确的是( )
A.A的能量一定高于C的能量
B.B的能量一定高于D的能量
C.反应物A与B的总能量一定低于生成物C与D的总能量
D.反应物A与B的总能量一定高于生成物C与D的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知空气﹣锌电池的电极反应为:锌片:Zn+20H﹣﹣2e﹣=ZnO+H20,石墨:02+2H20+4e﹣=40H﹣ . 根据此判断,锌片是( )
A.负极,并被氧化
B.负极,并被还原
C.正极,并被氧化
D.正极,并被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用硫铁矿烧渣(主要成分为Fe2O3,还含有少量Al2O3、 MgO、SiO2等杂质)制备铁红工艺流程如下:

回答下列问题:
(1)还原焙烧后,Fe元素的化合价为__________。
(2)“酸浸”实验中,需加入絮凝剂沉淀杂质。絮凝剂用量和过滤时间对铁红成份的影响如下表所示。由表可知,所采用的最佳实验条件为__________(填序号)。
序号 | 絮凝剂用量/×10-6t | 过滤时间/min | Fe2O3含量% | SiO2含量% |
① | 40 | 5 | 96.5 | 0.12 |
② | 50 | 10 | 97.9 | 0.10 |
③ | 60 | 20 | 98.3 | 0.07 |
④ | 100 | 40 | 99.4 | 0.01 |
⑤ | 150 | 150 | 99.5 | 0.008 |
(3)若“合成”中c(Mg2+)=0.01mol/L,加入NH4HCO3(设溶液体积增加1倍),当Fe2+恰好沉淀完全时,溶液中c(Fe2+)=1.0×10-5mol/L,此时是否有MgCO3沉淀生成?__________(列式计算)。FeCO3、MgCO3的Ksp分别为3.2×10-11、3.0×10-8。
(4)“合成”过程中发生反应的离子方程式为_____________。
(5)“合成”过程中温度对亚铁离子转化率的影响如下图,分析选择反应温度为40℃的原因是________。

(6)“煅烧”中由FeCO3制备Fe2O3的化学方程式为________。
(7)本流程中,铝元素是以________(填化学式)形式被除去的。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学式中,正确的是( )
A.甲烷的燃烧热为 890.3 kJmol﹣1 , 则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=﹣890.3 kJmol﹣1
B.500℃、30MPa 下,将 0.5mol N2和 1.5molH2置于密闭容器中充分反应生成 NH3(g),放热 19.3 kJ,其热化学方程式为:N2+3H2(g) ![]() 2NH3(g)△H=﹣38.6 kJmol﹣1
2NH3(g)△H=﹣38.6 kJmol﹣1
C.稀盐酸和 稀氢氧化钠溶液混合,其热化学方程式为:H+(aq)+OH﹣(aq)=H2O(l)△H=﹣57.3 kJmol﹣1
D.1molH2完全燃烧放热 142.9kJ,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l)△H=+285.8 kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两池电极材料都是铁棒与碳棒(如图)。诸回答下列问题:

(1)若两池中均盛放CuSO4溶液,反应一段时间后:
①有红色物质析出的是:甲池中的_____棒;乙池中的____棒。
②在乙池中阳极的电极反应是____________。
(2)若两池中均盛放饱和NaCl溶液。
①写出乙池中总反应的离子方程式:___________________。
②将湿润的淀粉KI试纸放在乙池附近,发现试纸变蓝,待一段时间后又发现蓝色褪去,这是因为过量的Cl2将生成的I2氧化。若反应的Cl2和I2的物质的量之比为5:1,且生成两种酸。该反应的化学方程式为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com