
【题目】已知空气﹣锌电池的电极反应为:锌片:Zn+20H﹣﹣2e﹣=ZnO+H20,石墨:02+2H20+4e﹣=40H﹣ . 根据此判断,锌片是( )
A.负极,并被氧化
B.负极,并被还原
C.正极,并被氧化
D.正极,并被还原
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.现有三种短周期元素:①H ②Na ③Cl。
(1)氢原子结构示意图______; ②的单质在③的单质中燃烧,生成物是一种_______化合物(填“离子”或“共价”)。
(2)①与③形成的化合物的电子式是_______________,该化合物中含有___________共价键(填“极性”或“非极性”)。
Ⅱ.现有四种烃分子的球棍模型(如图)。
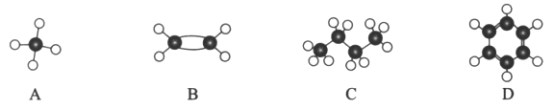
(1)与A互为同系物的是___________(填序号)。
(2)能使酸性高锰酸钾溶液褪色的物质是_____________(填序号)。
(3)C的同分异构体的结构简式是_____________________________。
(4)在光照条件下,A与氯气发生反应生成气态有机物的化学反应方程式是:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】治理SO2、CO、NOx污染是化学工作者研究的重要课题。
Ⅰ.硫酸厂大量排放含SO2的尾气会对环境造成严重危害。
(1)工业上可利用废碱液(主要成分为Na2CO3)处理硫酸厂尾气中的SO2,得到Na2SO3溶液,该反应的离子方程式为__________________________________。
Ⅱ.沥青混凝土可作为反应;2CO(g)+O2(g)![]() 2CO2(g)的催化剂。图甲表示在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。
2CO2(g)的催化剂。图甲表示在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。

(2)a、b、c、d 四点中,达到平衡状态的是__________________________________。
(3)已知c点时容器中O2浓度为0.02 mol/L,则50℃时,在α型沥青混凝土中CO转化反应的平衡常数K=____________(用含x的代数式表示)。
(4)下列关于图甲的说法正确的是_____________。
A.CO转化反应的平衡常数K(a)
B.在均未达到平衡状态时,同温下β型沥青混凝土中CO转化速率比α型要大
C.b点时CO与O2分子之间发生有效碰撞的几率在整个实验过程中最高
D.e点转化率出现突变的原因可能是温度升高后催化剂失去活性
Ⅲ.某含钴催化剂可以催化消除柴油车尾气中的碳烟(C)和NOx。不同温度下,将模拟尾气(成分如下表所示)以相同的流速通过该催化剂,测得所有产物(CO2、N2、N2O)与NO的相关数据结果如图乙所示。
模拟尾气 | 气体(10mol) | 碳烟 | ||
NO | O2 | He | ||
物质的量(mol) | 0.025 | 0.5 | 9.475 | n |
(5)375℃时,测得排出的气体中含0.45 molO2和0.0525 mol CO2,则Y的化学式为______________。

(6)实验过程中采用NO模拟NOx,而不采用NO2的原因是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.聚合物 ![]() 可由单体CH3CH=CH2和CH2=CH2加聚制得
可由单体CH3CH=CH2和CH2=CH2加聚制得
B.1 molCH3COOH与1mol CH3CH2OH在浓硫酸共热下生成的乙酸乙酯分子数为NA
C.乙醇、苯酚、乙酸都有羟基,但是羟基上的H活泼性不同,主要是基团之间相互影响造成的
D.等物质的量的乙炔和乙醛分别充分燃烧,所耗用氧气的量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,往HA溶液中滴加NaOH溶液,溶液中HA和A-二者中各自所占的物质的量分数(α)随溶液pH变化的关系如图所示。下列说法正确的是
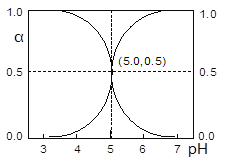
A. 在pH=5.0的溶液中,c(A-)=c(HA),c(OH-)= c(H+)
B. pH=7的溶液中,α(HA)=0,α(A-)=1.0
C. 25℃时,Ka(HA)=1×10-5
D. pH=5.0时,溶液中水电离产生的c(H+)=1×10-5mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己烷雌酚的一种合成路线如图: 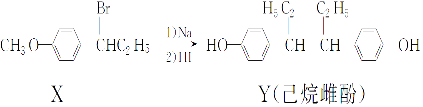
下列叙述正确的是( )
A.在NaOH 水溶液中加热,化合物X 可发生消去反应
B.在一定条件下,化合物Y可与浓溴水发生取代反应
C.用FeCl3溶液不能鉴别化合物X和Y
D.化合物Y中不含有手性碳原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在T℃时,将0.6molX和0.4molY置于容积为2L的密闭容器中(压强为mPa)发生反应:3X(g)+Y(g)![]() 2Z(g)该反应为放热反应。若保持温度不变,某兴趣小组同学测得反应过程中容器内压强随时间变化如图所示:
2Z(g)该反应为放热反应。若保持温度不变,某兴趣小组同学测得反应过程中容器内压强随时间变化如图所示:
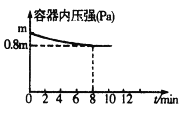
(1)8分钟内Z的平均生成速率为____________。
(2)X的平衡转化率为____________。
(3)将amolX与bmolY的混合气体发生上述反应,反应到某时刻各物质的量恰好满足:n(X)=n(Y)=n(Z),则原混合气体中a∶b=____________。
(4)下列措施能加快化学反应速率的是____________。
A.恒压时充入He B.恒容时充入He
C.恒容时充入X D.及时分离出Z
E.升高温度 F.选择高效的催化剂
(5)仍在T℃时,将0.6molX和0.4molY置于一容积可变的密闭容器中。下列各项能说明该反应已达到平衡状态的是______。
a.容器内X、Y、Z的浓度之比为3∶1∶2
b.3v正(X)=v逆(Y)
c.混合气体的密度保持不变
d.容器中气休的平均相对分子质量不随时间而变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表列出了①~⑧八种元素在周期表中的位置:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
二 | ① | |||||||
三 | ② | ③ | ④ | ⑤ | ⑦ | |||
四 | ⑥ | ⑧ |
请按要求回答下列问题:
(1)元素③的原子结构示意图是_________________________,以上元素的最高价氧化物形成的水化物酸性最强的是_______________________(填分子式)。
(2)②、③、⑦三种元素的原子形成的简单离子半径由大到小的顺序排列为_____________(用离子符号表示);②、③、⑥三种元索的最高价氧化物对应的水化物碱性由弱到强的顺序是__________________(用化学式表示)。
(3)向元素②的单质与水反应后的溶液中加入元素④的单质,发生反应的化学方程式为________________。
(4)用离子方程式证明⑦⑧两元素非金属性的强弱__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.没有单质参加的化合反应也可能是氧化还原反应
B.凡有单质生成的化学反应一定是氧化还原反应
C.阳离子只能得电子被还原,阴离子只能失电子被氧化
D.氧化剂本身被还原,生成氧化产物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com